2025年6月30日、「日本型パテントリンケージ制度において医薬品特許の専門家の意見を反映させる仕組みの構築に向けた調査研究」と題する報告書が、厚生労働科学研究成果データベースに公開されました(https://mhlw-grants.niph.go.jp/project/178094)。
2024年7月25日に開催された厚生科学審議会(医薬品医療機器制度部会)において、「後発医薬品等の承認審査におけるパテントリンケージ制度の運用改善」が議題として取り上げられ、バイオ後続品も含めたパテントリンケージ制度の改善のため、医薬品特許や薬事規制に詳しい学識経験者の協力を得て調査研究を行い、承認審査において考慮すべき特許の範囲等を明確化した上で、専門家への意見照会制度の導入について検討を進めることとされていました(2024.07.25ブログ記事「【速報】厚生科学審議会(医薬品医療機器制度部会) パテントリンケージ制度の運用改善について議論 医薬品特許の専門家への意見照会制度の導入検討へ」参照)。

本調査研究では、以下の3点についての検討結果が取りまとめられています。
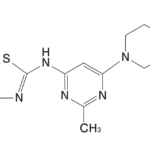
1.後発医薬品の承認審査において考慮される先発医薬品の「物質特許」及び「用途特許」の定義・範囲
2.専門委員による特許抵触リスクに関する評価基準
3.パテントリンケージにおける専門委員制度の運用指針(案)の考え方
研究報告書(概要版)では次のように総括されています。
「多様な関係者へのヒアリング調査の結果、パテントリンケージ制度に専門委員制度を導入することについては概ね賛同が得られた一方で、業界団体においては団体ごとの意見の隔たりが大きいように感じられた。また、医薬品特許実務に精通した専門家は、事実上、先発企業又は後発企業のいずれかに偏った評価を行うのではないかとの懸念や、運用方法が未だ不明確との指摘もあった。こうした意見も踏まえた引き続きの検討が必要と考えられる。本調査研究の成果が、パテントリンケージの運用改善に資することに期待したい。」

パテントリンケージ制度の課題改善に向け、検討結果を報告書として取りまとめてくださった加藤先生をはじめとする研究メンバーの皆さまに、心より敬意を表したいと思います。
さて、今回提案された「専門家意見照会制度」についてですが、専門家からの意見書には「何らの法的拘束力も有さない」とされており、仮に特許権を侵害する後発医薬品が承認された場合(誤ってパテントリンケージが解除された場合)、先発企業側はこれまでどおり差止めを求めて訴訟を提起することになると考えられます。報告書の内容を踏まえる限り、示された「物質特許」及び「用途特許」の定義・範囲や評価基準には看過できない大きな問題点がありそうです。製薬業界としては、厚労省に対し、問題点を明確に指摘し、是正を求める必要があるでしょう。厚労省は、性急な運用開始によって問題の幕引きを図るのではなく、業界との真摯な対話を通じて、制度の実効性と透明性を高めるための運用改善に真剣に取り組むべきです。問題点を放置又は指摘を無視したまま制度運用を開始することは、決して許されるものではありません。
一方で、先発医薬品の特許保護と後発医薬品の安定供給のバランスを、より予測可能な形で確保するためには、やはり「法的拘束力を有する裁判所の判断」に基づいて厚労省がパテントリンケージ解除の可否を判断する、いわゆる米国型の制度の方が望ましいのではないかと感じます。
実際に、研究を分担された下川先生は、分担報告書の最後でそのような制度改正の必要性に言及されています。また、成川先生も同報告書の中で、後発品の承認申請の事実が先発企業に通知される仕組みの必要性を強調されています。
しかし、こうした有意義な提言がなされたにもかかわらず、それらは将来的な検討課題として先送りにされており、本報告書自体も「専門家意見を反映させる仕組みの構築」に限定された内容であることを考えると、抜本的な制度改革の実現は依然として困難であることを改めて感じさせられます。
厚労省としては、今回提案された制度をそのまま採用し、運用に移していく方針と見られますが、分担報告書で指摘された課題については、今後さらに丁寧な検討が進められることを切に願っています。
なお、2025年5月2日には、米国研究製薬工業協会(PhRMA)が厚労省医薬局医薬品審査管理課宛に意見書を提出し、自らの日本語ウェブサイト上で公開しました。この中でPhRMAは、厚労省が検討している「専門家意見照会制度」について、重大な懸念があることを明確に表明しています(2025.05.03ブログ記事「【速報】PhRMA、厚労省提案のパテントリンケージ制度に懸念を表明」参照)。

専門家意見照会制度を導入したとしても、その制度が「法的拘束力を有する裁判所の判断」による紛争解決に代替するものではない以上、依然として実効性に疑問が残ります。



コメント