(1) 日本のパテントリンケージ制度の不透明感
厚生労働省は「医療用後発医薬品の薬事法上の承認審査及び薬価収載に係る医薬品特許の取扱いについて(平成21年6月5日付け医政経発第0605001号/薬食審査発第0605014号)」及び「承認審査に係る医薬品特許情報の取扱いについて(平成6年10月4日付け薬審第762号審査課長通知)」において、後発医薬品の薬事法上の承認審査にあたっては、先発医薬品の一部の効能・効果等に特許が存在する効能・効果等については承認しない方針であり、特許の存否は承認予定日で判断するものであることとしています。日本では法律上明文の規定はないものの、上記のような手続きが運用上設けられています。にもかかわらず、用途特許が有効に存続している場合でも、厚生労働省/PMDAが同用途(効能・効果)での後発医薬品を承認した事例がいくつか認められ、日本のパテントリンケージ制度がしっかり機能しているとはいえないのではないかという不透明感が顕在化してきたように思えた一年でした。
- 2018.09.19 「沢井製薬 v. シャイア」 知財高裁平成29年(行ケ)10171
炭酸ランタンの異なる水和物の進歩性が争点でしたが、背景にある高リン血症治療剤ホスレノール®の後発医薬品の承認プロセス(パテントリンケージ)において延長された特許権の効力を厚生労働省/PMDAはどのように判断したのか気になった事例です。本件特許(医薬用途特許)の存続期間延長登録出願が登録されており、「サワイ」品の製造承認(2018年2月15日)時点では、それぞれ延長された特許権の効力が同製品の製造・販売行為に及ぶ可能性が大いに考えられたわけです。本判決(2018年9月19日)で審決が取り消される判断が出されるまでは、特許庁の見解として特許及び全ての存続期間延長登録も有効であるとされていたわけですから、何故、厚生労働省・PMDAが「サワイ」品を2018年2月15日に承認したのかは理解に苦しむところです。
- 2018.10.22 「セルトリオン v. ジェネンテック」 知財高裁平成29年(行ケ)10106
本件特許(第5623681号)の無効審判では、特許庁は一応特許有効審決(2016年12月27日)を下していました。本件訴訟判決期日(2018年10月22日)がもう間近だったとはいえ、その状況での抗悪性腫瘍剤ハーセプチン®の第一三共品とファイザー品の後続医薬品の承認(2018年9月21日)でした。本件特許がパテントリンケージの用途特許として有効に存在していると認知されていたとしたら、厚労省/PMDAはどのように判断してそれら後続品を承認する判断に至ったのか、日本のパテントリンケージが一貫性を持って機能しているのか気になるところです。
- 東レがレミッチ®OD錠後発品を販売する沢井・扶桑を特許侵害で提訴
後発医薬品の承認プロセス(パテントリンケージ)において延長された特許権の効力を厚生労働省/PMDAはどのように判断したのか気になった事例です。沢井製薬および扶桑薬品工業が販売する後発医薬品である「ナルフラフィン塩酸塩OD錠2.5µg 『サワイ』」および「ナルフラフィン塩酸塩OD錠2.5µg 『フソ-』」(後発医薬品の効能・効果:次の患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)血液透析患者)は、ともに2018年2月15日に承認されています。その時点で、本件用途特許の延長登録出願(特願2017-700154号)がされている(特許権の存続期間の延長登録の出願があつたときは、存続期間は、延長されたものとみなされる(特許法67条の2第5項))状況であったわけですから、厚労省/PMDAは本件用途特許(延長効力)によるパテントリンケージをどのように考えてそれら後発品を承認する判断に至ったのか気になるところです。
参考文献:
- 「バイオ関連・医薬関連の特許保護の在り方についての調査、研究及び提言」についての答申(日本弁理士会バイオ・ライフサイエンス委員会、平成30年2月5日)
- パテント Vol.71, No.10, p54-65, 2018:「日本のパテントリンケージの運用実態について」平成29年度バイオ・ライフサイエンス委員会第5部会
- Law & Technology No.80, 2018.7:「日本型パテントリンケージ制度の諸問題(上)」篠原 勝美
- Law & Technology No.81, 2018.10:「日本型パテントリンケージ制度の諸問題(下)」篠原 勝美
(2) 2018年、医薬系”特許的”な判決を賑わせた会社は・・・ 中外製薬株式会社でした。
Trastuzumab
- 2018.10.22 「セルトリオン v. ジェネンテック」 知財高裁平成29年(行ケ)10106
ハーセプチン®乳癌術前術後補助化学療法発明の進歩性否定、定性的効果の記載にとどまる場合は進歩性判断に後出しデータ参酌せず - 2018.10.11 「ファイザー・セルトリオン v. ジェネンテック」 知財高裁平成29年(行ケ)10165; 平成29年(行ケ)10192
ハーセプチン®乳癌治療の用法用量発明の進歩性否定される - 中外がハーセプチン®バイオシミラー承認取得した第一三共とファイザーに対し用途特許侵害で差止訴訟提起
- ハーセプチン®用途特許侵害訴訟。日本化薬バイオシミラーの承認効能効果受け、中外が差止請求放棄
Emicizumab
- 血友病A治療薬HEMLIBRA®米国訴訟でバクスアルタは中外に対する訴え取り下げ
- ヘムライブラに対する特許侵害訴訟でバクスアルタが控訴
- 2018.03.28 「バクスアルタ v. 中外製薬」 東京地裁平成28年(ワ)11475
機能的表現抗体クレームの技術的範囲の解釈(中外エミシズマブ(ヘムライブラ®)) - 臨床開発中のエミシズマブについての特許侵害訴訟で中外勝訴
Rituximab
Ravulizumab
- 中外製薬が抗C5抗体ALXN1210(ravulizumab)を開発するアレクシオン社を特許侵害で提訴
- 中外が抗C5抗体ALXN1210(ravulizumab)開発中のアレクシオン社を日本でも特許侵害で提訴
Marduox® Ointment
(3) 過去の「医薬系”特許的”な判決を振り返る。」

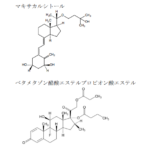
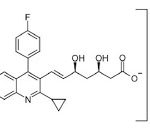
コメント
追加参考文献:
「弁理士会バイオ・ライフサイエンス委員会からの審議委嘱事項4「バイオ関連・医薬発明の特許保護の在り方についての調査及び研究」についての報告書(平成31年3月22日)」
によると、バイオ後続品に関する日本のパテントリンケージにおいて、承認可否については、後発医薬品に関する平成21.6.5厚労省課長通知(医政経発0605001/薬食審査発0605014)に従い後発医薬品と同様の運用がなされている一方で、薬価収載前の事前調整は(本調査時点で)行われていない・・・とのこと。
ハーセプチンについての経緯も同報告書で検討されている。