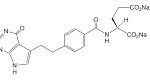
2017年3月3日付けの協和キリン富士フイルムバイオロジクス press releaseによると、協和キリン富士フイルムバイオロジクスは、ヒト型抗TNFαモノクローナル抗体製剤「アダリムマブ(Adalimumab)」バイオシミラー(開発番号:FKB327、先発薬:ヒュミラ(Humira)®)の製造販売承認申請に向けて準備しているところ、AbbVie社の「アダリムマブ」の用法用量の特許が公知の技術に照らして無効であるとして、2015年10月29日に当該特許の無効・確認訴訟を英国特許裁判所で提起していました。訴訟の過程で、AbbVie社は訴訟対象の同特許を取下げましたが、同裁判所は確認訴訟を継続する判決を2016年12月に下し、2017年3月3日付で、「アダリムマブ」の関節リウマチ、乾癬(かんせん)および関節症性乾癬の用法用量は公知または自明であるため特許性がないとの判決(Fujifilm Kyowa Kirin Biologics Company Ltd v Abbvie Biotechnology Ltd [2017] EWHC 395 (Pat) (03 March 2017))を下したとのことです。
アダリムマブ(Adalimumab)の英国での基本特許(EP 0,929,578)はSPC 含めて2018年10月15日に満了するため、その後も存続しているアダリムマブの用法用量特許がバイオシミラーの英国での販売の障壁となっていました。2016年度通年のヒュミラの全世界での売上高は営業ベースで160億7,800万ドル。
- 富士フイルム株式会社・協和発酵キリン株式会社 press release: 2017.03.03 「「アダリムマブ」の関節リウマチ、乾癬及び関節症性乾癬の用法用量に関する英国特許確認訴訟で勝訴」

コメント