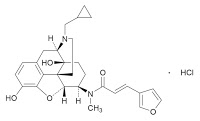
2018年12月19日付の東レのプレスリリース(「経口そう痒症改善剤「レミッチ®」用途特許に関する 特許権侵害訴訟提起について」)によると、東レは、2018年12月13日に沢井製薬および扶桑薬品工業を被告として東京地裁に特許権侵害訴訟を提起したとのことです。本件訴訟は、東レが製造販売承認を取得している経口そう痒症改善剤「レミッチ®」(「レミッチ®カプセル2.5µg」および「レミッチ®OD錠2.5µg」(一般名:ナルフラフィン塩酸塩))に関する用途特許(特許第3531170号、延長登録出願:特願2017-700154号)に基づき、沢井製薬および扶桑薬品工業が販売する後発医薬品である「ナルフラフィン塩酸塩OD錠2.5µg 『サワイ』」および「ナルフラフィン塩酸塩OD錠2.5µg 『フソ-』」(後発医薬品の効能・効果:次の患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)血液透析患者)の製造販売差止と損害賠償等を求めるものとのことです。
本件用途特許(第3531170号)は、オピオイドκ受容体作動性化合物を有効成分とする止痒剤に関する医薬用途発明を保護するものであり、J-PlatPatによると、20年の特許期間は2017年11月21日で満了しましたが、下記2017年3月の「レミッチ®OD錠2.5µg」の承認取得に基づいて、5年間の特許権存続期間延長登録を求める出願(特願2017-700154号)がされているようです。この訴訟で、延長された用途特許の効力が争われるのだとしたら、裁判所がどのように判断するのか大変興味深く、その判断内容に期待したいと思います。
- 2009年1月: 「血液透析患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)」の効能又は効果について「レミッチ®カプセル2.5µg」の製造販売承認を取得
- 2015年5月: 「慢性肝疾患患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)」の効能又は効果について追加承認を取得
- 2017年3月: 口腔内崩壊錠である「レミッチ®OD錠2.5µg」の製造販売承認を取得
- 2017年9月: 「レミッチ®カプセル2.5µg」および「レミッチ®OD錠2.5µg」について、「腹膜透析患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)」に関する有用性が認められ、既に承認を取得している効能又は効果と合わせて「透析患者、慢性肝疾患患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)」として追加承認を取得
ところで、沢井製薬および扶桑薬品工業が販売する後発医薬品である「ナルフラフィン塩酸塩OD錠2.5µg 『サワイ』」および「ナルフラフィン塩酸塩OD錠2.5µg 『フソ-』」(後発医薬品の効能・効果:次の患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)血液透析患者)は、ともに2018年2月15日に承認されています。その時点で、本件用途特許の延長登録出願(特願2017-700154号)がされている(特許権の存続期間の延長登録の出願があつたときは、存続期間は、延長されたものとみなされる(特許法67条の2第5項))状況であったわけですから、厚労省/PMDAは本件用途特許によるパテントリンケージをどのように考えてそれら後発品を承認する判断に至ったのかも気になるところです(厚労省/PMDAは、延長特許の効力を判断できず、当事者間の調整に委ねた・・・ということなのでしょうか)。
参考:
- 2018.12.19 東レ press release: 「経口そう痒症改善剤「レミッチ®」用途特許に関する 特許権侵害訴訟提起について」

コメント