1.フェブリク®錠について
帝人(株)(現 帝人ファーマ(株))は、1988年より尿酸降下薬の創薬研究に着手、1991年に非プリン型選択的キサンチンオキシダーゼ阻害剤であるフェブキソスタット(febuxostat)を発見、日本では、1995年からフェブキソスタットを有効成分とするフェブリク®錠の第I相臨床試験を開始し、2011年1月21日に「痛風、高尿酸血症」の効能・効果で製造販売承認を取得しました。その後、2016年5月23日に「がん化学療法に伴う高尿酸血症」の効能又は効果追加、用法及び用量追加承認を取得しました。フェブリク®錠の2018年度国内売上は358億円、国内では順調に販売拡大していますが、2020年3月5日付2020年度薬価基準改定告示(市場拡大再算定)により14.5~14.6%の引下げをうけました(厚生労働省 薬価基準改定の概要 別添4「市場拡大再算定品目及び効能変化再算定品目について」)。また、欧米では後発品の影響を受け収益が低下しているようです(2020.02.22 帝人2019年度第3四半期決算説明会資料 page 7)。
2.フェブリク®錠の再審査期間について
フェブリク®錠の医薬品インタビューフォーム(2020年3月(第8版))によると、フェブリク®錠の再審査期間は、痛風、高尿酸血症については当初の8年から10年(2011年1月21日~2021年1月20日)、がん化学療法に伴う高尿酸血症については当初の4年から4年8か月(2016年5月23日~2021年1月20日)に変更されています。2018年7月27日付の薬事・食品衛生審議会医薬品第一部会議事録及び2018年9月7日付の帝人プレスリリース「高尿酸血症・痛風治療剤「フェブリクⓇ」再審査期間延長の通知発出について」によると、フェブリク®錠の小児に対する用法・用量設定及び小児集団における有効性・安全性を把握する目的で治験を実施する必要があると認められ、国内再審査期間の2年間延長(2021年1月20日まで)が決定され、国内では2022年度前半まで後発品の参入は想定されないと発表されました(帝人2018年度第2四半期決算説明会資料 page 20)。
3.フェブリク®錠を保護する特許権について(日本)
フェブリク®錠の承認日(2011年1月21日及び2016年5月23日)をもとに存続期間延長登録出願されている帝人が権利者となっている特許をJ-PatPatで検索したところ、下記表1のとおり、特許及びそれら延長登録の存在が分かりました(これら以外に、フェブリク®錠を保護する出願または特許があるかどうかは未調査。以下、表1リスト特許のみを前提に考察。)。
物質特許は存続期間が延長されましたが、既に満了しています(2016年満了)。従って、表1にリストされた特許のうち、現存する特許は、(1)結晶特許3547707(2023又は2024年満了)、(2)製法特許3202607(2021年満了)、(3)製剤特許4084309(2026年満了)、(4)用途特許5907396(「腫瘍融解症候群の治療薬及び予防薬」に関する。2033年満了)となります。上記4つの特許は存在していますが、フェブリク®のジェネリック参入障壁として大きく関与するのは再審査期間の存在(2021年終了)であり、また加えて、用途特許5907396が特許係争上又はジェネリック承認審査上どのように扱われて関わってくるのかどうかが気になるところです。帝人ファーマはフェブリク®のオーソライズド・ジェネリック(AG)という選択肢を実行に移すのかどうかも気になります。
(1)結晶特許3547707について
下記事件を経て一部請求項を無効とする審決が確定しており、当該特許は存在していますがフェブリク®のジェネリック参入障壁としての効力は極めて低い(ジェネリックは特許回避可能)と考えられます。
(2)製法特許3202607について
存続期間が延長されました(2021年満了)が、フェブリク®錠の再審査期間が2021年1月20日まで延長され、2022年度前半まで後発品の参入は想定されないことから、ジェネリック参入障壁としての意義はなくなったと考えられます。
(3)製剤特許4084309について
存続期間が延長されました(2026年満了)が、当該特許の請求項は、結晶形(A晶)の限定のみならず特定の製剤成分を構成要件とする狭い特許請求の範囲となっています。従って、当該特許は存在していますがフェブリク®のジェネリック参入障壁としての効力は極めて低い(ジェネリックは特許回避可能)と考えられます。無効審判は請求されていません。
(4)用途特許5907396について
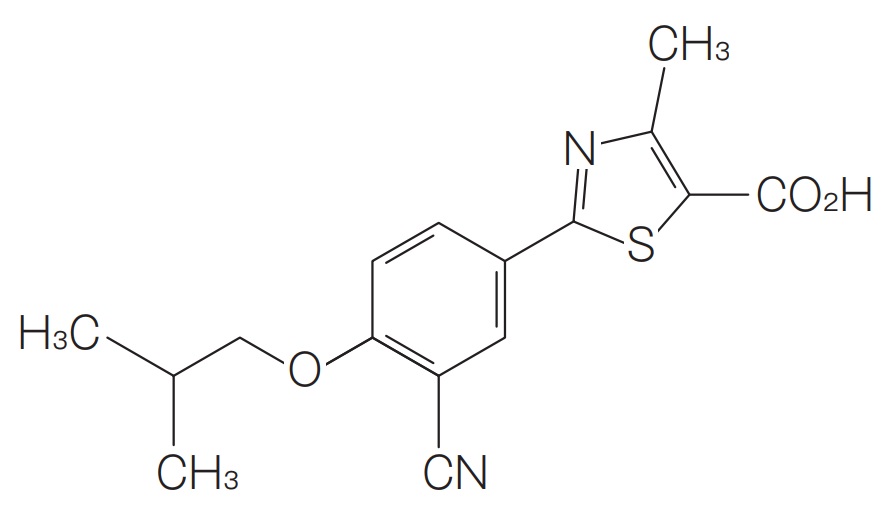
当該特許は2033年まで存続します。請求項1は、フェブリク®錠において2016年5月23日に追加された効能・効果「がん化学療法に伴う高尿酸血症」よりも広い高尿酸血症患者の範囲を保護しているようにも見えます。現在、無効審判が請求され、今後審理が係属していくと思われます。無効審判請求人がどのような無効理由を主張しているのか、その審理は2022年前半までにどう決着しているだろうか、ジェネリックメーカーがフェブリク®ジェネリックの「痛風、高尿酸血症」の承認申請をした際に当該特許はPMDA/厚労省による承認判断に影響するのか、ジェネリックメーカーによる「痛風、高尿酸血症」を効能・効果とするフェブリク®ジェネリックの販売行為に対して当該特許による権利行使は可能か・・・いろいろと気になるところです。
請求項1:
「・・・(略)・・・で表される2−フェニルチアゾール化合物又はそれらの医薬上許容される塩を有効成分として含有する、バーキット非ホジキンリンパ腫、リンパ芽球性非ホジキンリンパ腫、バーキット急性リンパ芽球性白血病、白血球数(WBC)が100,000以上である急性リンパ芽球性白血病、白血球数(WBC)が50,000以上である急性骨髄性白血病、若しくは単芽球性急性骨髄性白血病である、又は抗腫瘍治療に起因せずに腫瘍融解症候群が発症し、尿酸の血中測定値が8mg/dL以上である高尿酸血症及び腎機能低下が認められる、若しくは抗腫瘍治療の実施前に腫瘍融解症候群が発症し、尿酸の血中測定値が8mg/dL以上である高尿酸血症が認められる、高リスク患者における腫瘍融解症候群の治療薬又は予防薬。」
表1:フェブリク®錠の各承認に基づく再審査期間及び存続期間延長登録出願
(赤字はこれから来る再審査期間終了日または特許権の存続期間満了日)
|
痛風、高尿酸血症
承認2011.1.21
|
がん化学療法に伴う高尿酸血症(通常、成人にはフェブキソスタットとして60mgを1日1回経口投与する。)
承認2016.5.23
|
|
|
再審査期間(当初)
|
2011.1.21~2019.1.20 (8y)
|
2016.5.23~2020.5.22 (4y)
|
|
延長された
再審査期間
|
~2021.1.20
理由: 小児に対する用法・用量設定及び小児集団における有効性・安全性を把握する目的で治験を実施する必要があると認められたもの
|
|
|
物質特許
特許2725886
出願日1991.11.29
登録日1997.12.5
|
10mg (特願2011-700069)
~2011.11.29+5y
=~2016.11.29
|
|
|
20mg (特願2011-700094)
~2011.11.29+5y
=~2016.11.29
|
||
|
40mg (特願2011-700088)
~2011.11.29+5y
=~2016.11.29
|
||
|
製法特許
特許2834971
出願日1993.5.25
登録日1998.10.2
|
10mg (特願2011-700070)
~2013.5.25+5y
=~2018.5.25
|
|
|
20mg (特願2011-700095)
~2013.5.25+5y
=~2018.5.25
|
||
|
40mg (特願2011-700089)
~2013.5.25+5y
=~2018.5.25
|
||
|
製法特許
特許2706037
出願日1993.8.24
登録日1997.10.9
|
特願2011-700071拒絶査定
特願2011-700090拒絶査定
特願2011-700096拒絶査定
|
|
|
製法特許
特許3202607
出願日1996.8.1
登録日2001.6.22
|
10mg (特願2011-700072)
~2016.8.1+5y
=~2021.8.1
|
|
|
20mg (特願2011-700097)
~2016.8.1+5y
=~2021.8.1
|
||
|
40mg (特願2011-700091)
~2016.8.1+5y
=~2021.8.1
|
||
|
結晶特許
特許3547707
出願日1999.6.18
登録日2004.4.23
無効2016-800037
平成29(行ケ)10147
|
10mg (特願2011-700073)
~2019.6.18+5y
=~2024.6.18
|
10mg (特願2016-700212)
~2019.6.18+3y7m15d
=~2023.2.2
|
|
20mg (特願2011-700098)
~2019.6.18+5y
=~2024.6.18
|
20 mg (特願2016-700213)
~2019.6.18+3y7m15d
=~2023.2.2
|
|
|
40mg (特願2011-700092)
~2019.6.18+5y
=~2024.6.18
|
40mg (特願2016-700214)
~2019.6.18+3y7m15d
=~2023.2.2
|
|
|
製剤特許
特許4084309
出願日2003.3.28
登録日2008.2.22
|
10mg (特願2011-700074)
~2023.3.28+2y10m29d
=~2026.2.26
|
10mg (特願2016-700215)
~2023.3.28+3y7m15d
=~2026.11.12
|
|
20mg (特願2011-700099)
~2023.3.28+2y10m29d
=~2026.2.26
|
20mg (特願2016-700216)
~2023.3.28+3y7m15d
=~2026.11.12
|
|
|
40mg (特願2011-700093)
~2023.3.28+2y10m29d
=~2026.2.26
|
40mg (特願2016-700217)
~2023.3.28+3y7m15d
=~2026.11.12
|
|
|
用途特許
(w/福井大学)
特許5907396
出願日2013.10.22
登録日2016.4.1
無効2020-800008
|
10mg (特願2016-700218)
~2033.10.22+1m21d
=~2033.12.13 |
|
|
20mg (特願2016-700219)
~2033.10.22+1m21d
=~2033.12.13 |
||
|
40mg (特願2016-700220)
~2033.10.22+1m21d
=~2033.12.13 |
||
関連記事:
参考:
- フェブリク®錠の医薬品インタビューフォーム(PMDA医療用医薬品情報検索)
- 2020.03.05 厚生労働省 薬価基準改定の概要 別添4「市場拡大再算定品目及び効能変化再算定品目について」
- 2020.02.22 帝人2019年度第3四半期決算説明会資料
- 2018.07.27 薬事・食品衛生審議会医薬品第一部会議事録
- 2018.09.07 帝人プレスリリース「高尿酸血症・痛風治療剤「フェブリクⓇ」再審査期間延長の通知発出について」
- 2018.11.05 帝人2018年度第2四半期決算説明会資料

コメント
【追加情報】
2022年2月15日、フェブリク®ジェネリックが初承認。
・第一三共エスファがAGで「痛風、高尿酸血症」と「がん化学療法に伴う高尿酸血症」のフル効能。
2022.02.15 第一三共エスファ press release: オーソライズド・ジェネリック(AG)製品の製造販売承認取得のお知らせ
https://www.daiichisankyo-ep.co.jp/home/img/4_5.pdf
・他のジェネリックの効能効果は「痛風、高尿酸血症」のみ(虫食い)。「がん化学療法に伴う高尿酸血症」には特許あるが、その特許無効審判事件は現時点で審決に至っていないことによる。
【追加情報】
2022.04.06 用途特許5907396の特許無効審判事件について、訂正後クレーム1~5を無効とする審決。これにより、ジェネリックが虫食いからフル効能となる見込み。
【追加情報】
2022.06.16 厚生労働省は2022年6月の後発品の薬価基準追補収載を官報告示。17日に収載される。初後発品のうち収載企業が最も多いのはフェブリク®(一般名: フェブキソスタット)の13社50品目。このうち第一三共エスファの製品であるフェブキソスタット錠10mg/20mg/40mg「DSEP」はオーソライズド・ジェネリック(AG)で、帝人ファーマより供給を受け第一三共エスファが販売する(2022.06.16 第一三共エスファpress release: ジェネリック医薬品新発売のお知らせ)。
【追加情報】
フェブリク®(フェブキソスタット)の用途特許5907396の無効審決取消訴訟(令和4年(行ケ)10044, 10058)は、判決言い渡し日前にその訴えは取り下げられたようです(知財高裁HP 審決取消等訴訟(特許・実用新案)係属中事件一覧表/終局事件一覧表(Excelファイル)より)。
2023.06.26 帝人ファーマ press release: 痛風・高尿酸血症治療剤「フェブリク錠」が小児適応追加の承認を取得
https://www.teijin-pharma.co.jp/pressrelease/2023/20230626.pdf