2020年6月29日、協和キリン富士フイルムバイオロジクスは、ヒト型抗ヒトTNF-αモノクローナル抗体製剤「ヒュミラ®」のバイオシミラー医薬品『アダリムマブBS皮下注「FKB」』に関し、先発医薬品であるヒュミラ®と一部同じ適応症で日本において医薬品製造販売承認を取得しました(2020.06.29 協和キリン富士フイルムバイオロジクス press release: ヒト型抗ヒトTNF-αモノクローナル抗体製剤「アダリムマブ」のバイオシミラー医薬品として日本初『アダリムマブBS皮下注「FKB」』 国内製造販売承認取得のお知らせ)。
そして、2020年11月25日、薬価収載。日本でもとうとうヒュミラ®のバイオシミラーが販売されます。
以下に、先発医薬品であるヒュミラ®(HUMIRA®)の概略と共に、そのバイオシミラーの市場参入に成功した協和キリン富士フイルムバイオロジクスが仕掛けた特許訴訟を振り返ります。
1.先発医薬品ヒュミラ®(HUMIRA®)について
ヒュミラ®皮下注の有効成分であるアダリムマブ(遺伝子組み換え)(Adalimumab)は、Knoll社(現AbbVie社)により創製されたヒトTNFαに対するヒトIgG1モノクローナル抗体です。
日本においては、2008年4月に関節リウマチ(既存治療効果不十分な場合に限る)を効能・効果として承認されて以降、尋常性乾癬、関節症性乾癬、強直性脊椎炎、クローン病、若年性特発性関節炎等に関する効能・効果で承認されています。製造販売(輸入)元はアッヴィ、販売元はエーザイ(プロモーション提携:EAファーマ)であり、エーザイの発表(2020.05.13 エーザイ2020年3月期決算参考資料)によると、ヒュミラ®の2019年度の日本売上高は519億円とのことです。
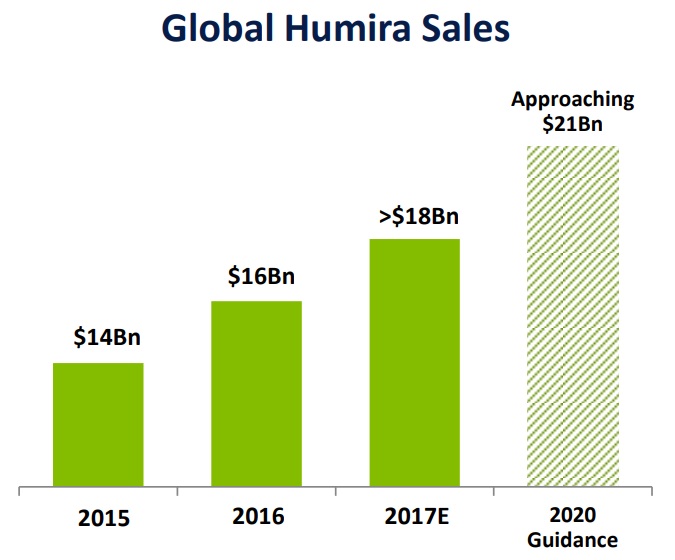
海外では、2002年にAbbott Laboratories社(現AbbVie社)がFDAより関節リウマチの承認を取得して以来、販売名HUMIRA®として各国で発売されています。協和キリン富士フイルムバイオロジクスの発表によると、本剤は2019年に世界で268.5億ドルの売上高を記録、世界で最も売れた医薬品と言われています。AbbVie社の発表(2019 Annual Report on Form 10-K and 2020 Proxy Statement)によると、2019年度のHUMIRA®のグローバル売上高は$19,169MMであり、AbbVie社の2019年全売上収益の58%を占めています。
2.協和キリン富士フイルムバイオロジクスがAbbVie社に仕掛けた特許訴訟
(1)欧州
協和キリン富士フイルムバイオロジクスは、AbbVie社の「アダリムマブ」の用法用量の特許が公知の技術に照らして無効であるとして、2015年10月29日に当該特許の無効・確認訴訟を英国特許裁判所で提起していました。訴訟の過程で、AbbVie社は訴訟対象の同特許を取下げましたが、同裁判所は確認訴訟を継続する判決を2016年12月に下し、2017年3月3日付で、「アダリムマブ」の関節リウマチ、乾癬(かんせん)および関節症性乾癬の用法用量は公知または自明であるため特許性がないとの判決を下しました。より詳しくは下記記事(AbbVieアダリムマブ(ヒュミラ®) 用法用量特許 英国で無効判決)をご覧ください。

協和キリン富士フイルムバイオロジクスは、AbbVie社より、「アダリムマブ」のバイオシミラー「Hulio®」の欧州各国における販売などに関して、実施料支払いを伴う非独占的な権利を獲得し、Mylan社(現Viatris社)はそのサブライセンスの権利を有しています。
- 2018.09.20 富士フィルム/協和発酵キリン/Mylan N.V. press release: 「アダリムマブ」のバイオシミラー医薬品「Hulio ®」欧州委員会(EC)から販売承認取得
- 2018.10.19 Mylan press release: Mylan Launches Hulio™ (Biosimilar Adalimumab) in Markets Across Europe
- The European Medicines Agency (EMA): Hulio
欧州での基本特許はSPC含めて2018年10月15日に満了しました。その後の参入障壁となっていた用法用量特許が無効となったこと、AbbVie社が複数のバイオシミラー会社と和解したことで欧州ではバイオシミラーが参入しています。
「Hulio®」は欧州で初めて承認された日本産バイオシミラーです。10社以上の会社がアダリムマブのバイオシミラーの開発を進めていましたが、協和キリン富士フイルムバイオロジクスは「Hulio®」の独占的販売権を付与したMylan社と提携し、2018年9月に欧州医薬品庁(EMA)より製造販売の承認を得て、1番手グループとして2018年10月よりMylan社による販売を開始しました。
(2)米国
2020年7月9日、協和キリン富士フイルムバイオロジクスは、「Hulio®」が米国FDAでも承認を得た旨の発表を行いました。その発表には、Mylan社が「AbbVie社とのライセンス契約に基づき、2023年7月に「Hulio®」を米国市場に投入できる見込み」とあります。
- 2020.07.09 協和キリン富士フイルムバイオロジクス press release: 「アダリムマブ」のバイオシミラー医薬品「Hulio®」 米食品医薬品局(FDA)より販売承認を取得。
2018年7月17日に、AbbVie社はHUMIRA®に関連する知財について米国及び他の国(欧州を除く)における非独占ライセンスをMylan社に対して付与し、特に、米国でのライセンスは2023年7月31日に始まると発表しています(2018.07.17 AbbVie press release: AbbVie Announces HUMIRA® (adalimumab) Patent License with Mylan)。
AbbVie社の2019 Annual Report(2019 Annual Report on Form 10-K and 2020 Proxy Statement)によると、AbbVie社はいくつかのバイオシミラー会社と特許係争の和解・ライセンス契約を締結しており、その契約の下、そのライセンスが欧州では2018年に、また米国では2023年に始まるとしています。米国では、HUMIRA®のバイオシミラーの市場参入が2023年に始まると想定されます。
The United States composition of matter (that is, compound) patent covering adalimumab expired in December 2016, and the equivalent European Union patent expired in October 2018 in the majority of European Union countries. In the United States, non-composition of matter patents covering adalimumab expire no earlier than 2022. AbbVie has entered into settlement and license agreements with several adalimumab biosimilar manufactures. Under the agreements, the license in the United States will begin in 2023 and the license in Europe began in 2018.
2019 Annual Report on Form 10-K and 2020 Proxy Statement
(3)日本
協和キリン富士フイルムバイオロジクスは、AbbVie社が保有するヒュミラ®を保護する日本特許第5840364号(製剤特許)に対して特許無効審判を請求(無効2016-800123)しましたが、請求不成立審決となったため、2018年4月20日に審決取消訴訟を提起していました(平成30年(行ケ)10052)。
50mg/mL以上200mg/mL以下の濃度のアダリムマブ及び水を含む水性製剤であって、前記製剤は、40℃で1ヶ月、又は、2から8℃で1年間液体状態で保存したとき、少なくとも95%が単量体であるアダリムマブを含み、かつ前記製剤は2.5mS/cm未満の伝導度を有する、水性製剤。
しかし、2019年2月にその訴えを取り下げたことから、協和キリン富士フイルムバイオロジクス及び/又はMylan社側とAbbVie社との間で日本市場においても何らかの和解をしたのではないかと推測されました。ちょうど、AbbVie社がHUMIRA®に関連する知財の非独占ライセンスをMylan社に付与すると発表した時期に一致します(2018.07.17 AbbVie press release: AbbVie Announces HUMIRA® (adalimumab) Patent License with Mylan)。
2020年6月29日、協和キリン富士フイルムバイオロジクスは、ヒト型抗ヒトTNF-αモノクローナル抗体製剤「ヒュミラ®」のバイオシミラー医薬品『アダリムマブBS皮下注「FKB」』に関し、先発医薬品であるヒュミラ®と一部同じ適応症、具体的には、
を効能・効果として、日本において医薬品製造販売承認を取得しました。
しかし、上記承認された適応症のうち、クローン病については、AbbVie社が保有する特許の関係が残っていると思われます。
ひとつは、AbbVie社が保有するアダリムマブを保護する基本特許3861118(出願日1997年2月10日)であり、ヒュミラ®(40mgシリンジ0.8mL製剤)のクローン病の効能効果追加承認に基づき存続期間が延長登録(2011-700033)されましたが、それも2021年2月5日には満了します。
もうひとつは、AbbVie社が保有するクローン病の用法用量特許5748317(出願日2005年4月11日)であり、2025年4月11日が満了日となります(40mgシリンジ0.8mL製剤におけるクローン病の効能効果追加承認に基づいての延長はありません)。
協和キリン富士フイルムバイオロジクスは、日本についても欧米と同様にAbbVie社からアダリムマブ・バイオシミラーに関するライセンスを取得していると推測されること、日本では2020年11月25日にそのバイオシミラー製品の薬価収載に至ったことから、おそらく上記クローン病の用法用量特許5748317の存続期間満了(2025年)を待たずに、例えば基本特許381118のクローン病の延長期間が満了する2021年2月5日に販売開始するのかもしれません。
3.まとめ
ヒュミラ®(HUMIRA®)のバイオシミラーは海外で多くの製薬会社が参入してきています。そのなかで、協和キリン富士フイルムバイオロジクスは欧州での特許訴訟を進め、AbbVie社からの非独占ライセンスを獲得し、Mylan社との提携によって欧州でのアダリムマブ・バイオシミラー市場に一番手グループとして参入することに成功しました。
米国でも、2023年に多くのメーカーからアダリムマブ・バイオシミラーの市場参入が予想され、極めてcompetitiveな状況になると予想されますが、Mylan社と提携したことで協和キリン富士フイルムバイオロジクスは米国市場参入の足固めができたと言えるでしょう。
日本では、協和キリン富士フイルムバイオロジクスが一番手でアダリムマブ・バイオシミラーの承認を取得し、2020年11月25日に薬価収載となりました。その販売開始が待たれます。
4.その他(参考)
- 2019.05.14 AbbVie press release: AbbVie Resolves HUMIRA® (adalimumab) U.S. Patent Litigation with Boehringer Ingelheim
- 2018.11.30 AbbVie press release: AbbVie Announces HUMIRA® (adalimumab) Global Patent License with Pfizer
- 2018.11.06 AbbVie press release: AbbVie Announces HUMIRA® (adalimumab) Global Patent License with Momenta
- 2018.10.18 AbbVie press release: AbbVie Announces Global Resolution of HUMIRA® (adalimumab) Patent Disputes with Fresenius Kabi
- 2018.10.11 AbbVie press release: AbbVie Announces Global Resolution of HUMIRA® (adalimumab) Patent Disputes with Sandoz
- 2018.07.17 AbbVie press release: AbbVie Announces HUMIRA® (adalimumab) Patent License with Mylan
- 2018.04.05 AbbVie press release: AbbVie Announces Global Resolution of HUMIRA® (adalimumab) Patent Disputes with Samsung Bioepis
- 2017.09.28 AbbVie press release: AbbVie Announces Global Resolution of HUMIRA® (adalimumab) Patent Disputes with Amgen

コメント
【追記】基本特許3861118、4404181、4890997が、新製剤40mgシリンジ0.4mL/ 80mgシリンジ0.8mL製剤追加承認/クローン病の用法用量追加承認に基づく存続期間延長登録がなされそれらが2021年2月15日に満了。このタイミングでヒュミラのBSがとうとう日本で発売・・・
2021.02.15 協和キリン富士フィルムバイオロジクス press release:「ヒト型抗ヒトTNF-αモノクローナル抗体製剤「アダリムマブ」のバイオシミラー医薬品として日本初『アダリムマブBS皮下注「FKB」』 新発売のお知らせ」
https://fujifilmkyowakirin-biologics.com/ja/information/pack/pdf/article_210215.pdf
2021.05.18 The Committee on Oversight and Reform Press Release: Oversight Committee Held Hearing with AbbVie CEO and Experts on Pricing Practices for Humira and Imbruvica
https://oversight.house.gov/news/press-releases/oversight-committee-held-hearing-with-abbvie-ceo-and-experts-on-pricing
“Chairwoman Maloney released a staff report with new documents and details about AbbVie Inc., which sells the anti-inflammatory drug Humira and the cancer drug Imbruvica.”
Staff report with new documents:
https://oversight.house.gov/sites/democrats.oversight.house.gov/files/Committee%20on%20Oversight%20and%20Reform%20-%20AbbVie%20Staff%20Report.pdf
https://oversight.house.gov/sites/democrats.oversight.house.gov/files/COR-AbbVie-Selected-Investigation-Documents.pdf
Video testimony: https://oversight.house.gov/legislation/hearings/on-unsustainable-drug-prices-part-iii-testimony-from-abbvie-ceo-richard