*Pharma/IP news
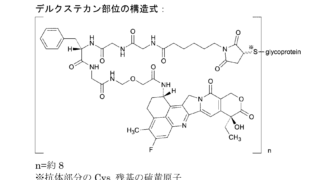
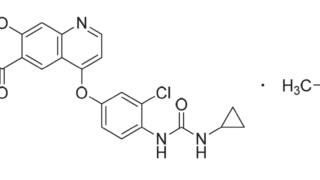
*Pharma/IP news ENHERTU®を巡るADC特許紛争が終結 Seagenが不服申立てせず
第一三共株式会社(以下「第一三共」)とSeagen Inc.(以下「Seagen社」)との間では、ENHERTU®(エンハーツ®)を含むADC技術をめぐり、米国において複数の法的係争が進行していました。2026年3月10日、第一三共は、下記判決に対して、不服申立て期限であった2026年3月2日(現地時間)までにSeagen社が手続きを行わなかったことから、Seagen社との特許係争が終結したと公表...