 *Topics
*Topics 2018年、医薬系”特許的”な判決を振り返る。
(1) 日本のパテントリンケージ制度の不透明感厚生労働省は「医療用後発医薬品の薬事法上の承認審査及び薬価収載に係る医薬品特許の取扱いについて(平成21年6月5日付け医政経発第0605001号/薬食審査発第0605014号)」及び「承認審査に係る医薬品特許情報の取扱いについて(平成6年10月4日付け薬審第762号審査課長通知)」において、後発医薬品の薬事法上の承認審査にあたっては、先発医薬品の一部の...
 *Topics
*Topics 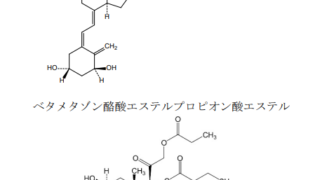 *Case2018
*Case2018 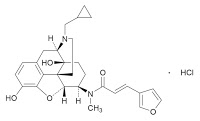 *Pharma/IP news
*Pharma/IP news 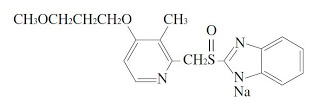 *Pharma/IP news
*Pharma/IP news 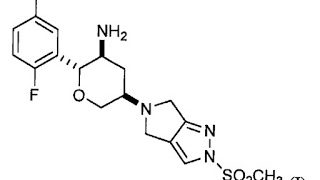 *Case2018
*Case2018  *Pharma/IP news
*Pharma/IP news 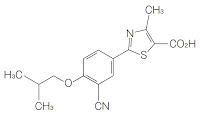 *Case2018
*Case2018 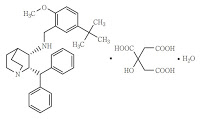 *Case2018
*Case2018 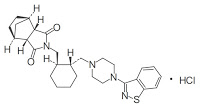 *Pharma/IP news
*Pharma/IP news  *Case2018
*Case2018  *Case2018
*Case2018  *Pharma/IP news
*Pharma/IP news 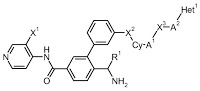 *Case2018
*Case2018  *Case2018
*Case2018  *Case2018
*Case2018 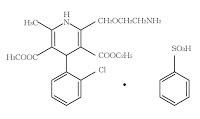 *Case2018
*Case2018  *Case2018
*Case2018  *Pharma/IP news
*Pharma/IP news  *Case2018
*Case2018  *Case2018
*Case2018 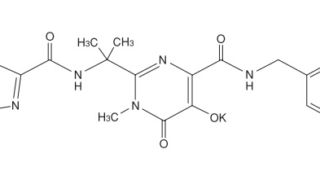 *Case2018
*Case2018  *Case2018
*Case2018  *Pharma/IP news
*Pharma/IP news  *Pharma/IP news
*Pharma/IP news  *Case2018
*Case2018  *Pharma/IP news
*Pharma/IP news 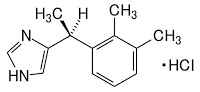 *Case2018
*Case2018  *Case2018
*Case2018  *Case2018
*Case2018  *Pharma/IP news
*Pharma/IP news 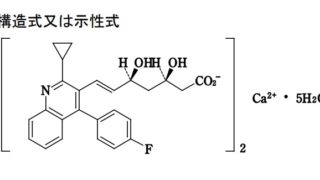 *Pharma/IP news
*Pharma/IP news 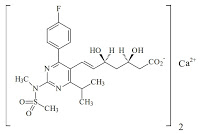 *Case2018
*Case2018  *Case2018
*Case2018 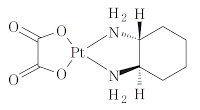 *Pharma/IP news
*Pharma/IP news  *Case2018
*Case2018  *Pharma/IP news
*Pharma/IP news 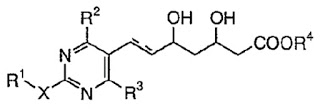 *Case2018
*Case2018  *Pharma/IP news
*Pharma/IP news  *Pharma/IP news
*Pharma/IP news  *Pharma/IP news
*Pharma/IP news  *Case2018
*Case2018 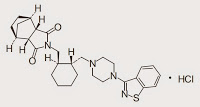 *Pharma/IP news
*Pharma/IP news  *Pharma/IP news
*Pharma/IP news  *Pharma/IP news
*Pharma/IP news 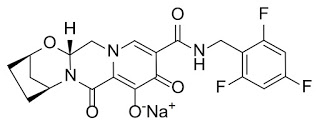 *Pharma/IP news
*Pharma/IP news 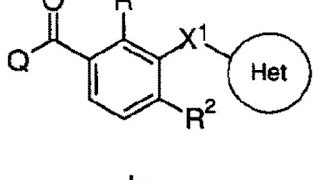 *Case2018
*Case2018  *Pharma/IP news
*Pharma/IP news 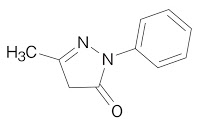 *Pharma/IP news
*Pharma/IP news  *Case2018
*Case2018  *Pharma/IP news
*Pharma/IP news