 2023年2月8日、サノフィ株式会社による「カバジタキセル(ジェブタナ®)に関する特許権」の謹告文が掲載されました。
2023年2月8日、サノフィ株式会社による「カバジタキセル(ジェブタナ®)に関する特許権」の謹告文が掲載されました。
- 2023.02.08 日刊薬業: 【謹告】カバジタキセル(ジェブタナ®)に関する特許権について
サノフィ株式会社は、カバジタキセル アセトン付加物(cabazitaxel acetonate)を有効成分とするジェブタナ®点滴静注60mgを製造販売しており、サノフィのグループ会社であるアベンティス・ファーマ・ソシエテ・アノニム社が、カバジタキセルの前立腺癌への使用に関する日本国特許第5566466号および第6182510号を保有しており、これらの特許は有効に存続しているとのことです。
ジェブタナ®点滴静注60mg(一般名:カバジタキセル アセトン付加物)は、Rhone-Poulenc Rorer 社(現 Sanofi 社)によりフランスで見出され、ヨーロッパイチイの針状葉から抽出した10-デアセチルバッカチンⅢから半合成されたタキサン系抗悪性腫瘍剤であり、日本では、2014年7月4日に「前立腺癌」を効能又は効果として、製造販売承認を取得しました。
ジェブタナ®点滴静注60mgの添付文書(2020年1月改訂(第1版))には以下の記載があります。
前立腺癌
5.効能又は効果に関連する注意
5.1 本剤は外科的又は内科的去勢術を行い、進行又は再発が確認された患者を対象とすること。
5.2 本剤の化学療法未治療の前立腺癌における有効性及び安全性は確立していない。
5.3 「17.臨床成績」の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で適応患者の選択を行うこと。
6.用法及び用量
プレドニゾロンとの併用において、通常、成人に 1 日 1 回、カバジタキセルとして25mg/m2(体表面積)を 1 時間かけて3 週間間隔で点滴静注する。なお、患者の状態により適宜減量すること。
再審査期間(8年)は2022年7月3日に終了しており、ジェブタナ®点滴静注60mgを保護する有効な特許権の存在が後発医薬品の参入障壁となります。
謹告文で挙げられている特許第5566466号および第6182510号の概要は以下のとおりです。
特許第5566466号に係る特許権は、存続期間が延長され(+6日)、満了日は2030年11月2日となっています。特許無効審判は請求されていないようです。
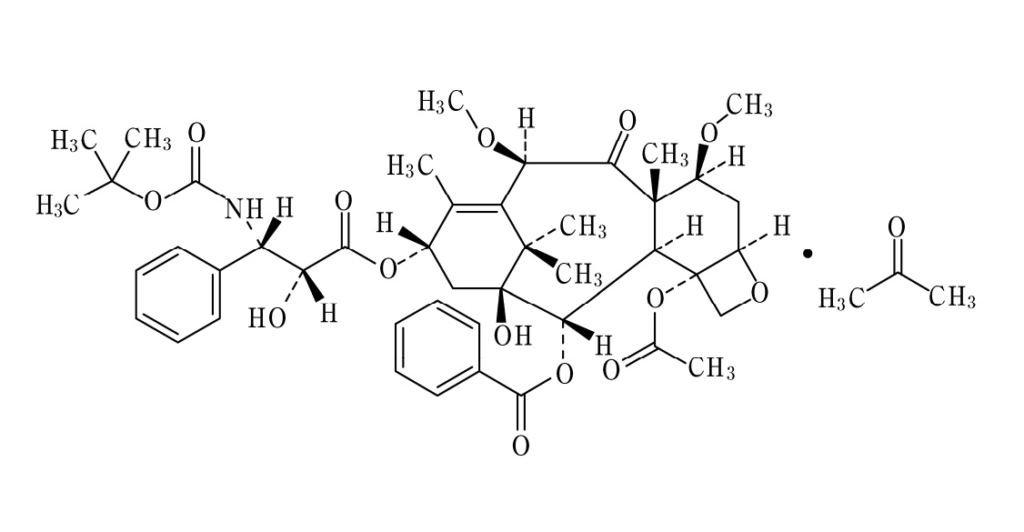
式:
【化1】
の化合物を含む、進行性転移性前立腺癌を治療するための薬学的組成物であって、
化合物が塩基形態、水和物形態または溶媒和物の形態であってよく、化合物がプレドニゾンまたはプレドニゾロンと組み合わせられ、治療される患者がドセタキセルベースのレジメンで以前に治療されており、前立腺癌が去勢抵抗性前立腺癌またはホルモン不応性前立腺癌である、前記組成物。
分割出願として派生した特許第6182510号に係る特許権の存続期間満了日は2030年10月27日となっています。特許無効審判は請求されていないようです。
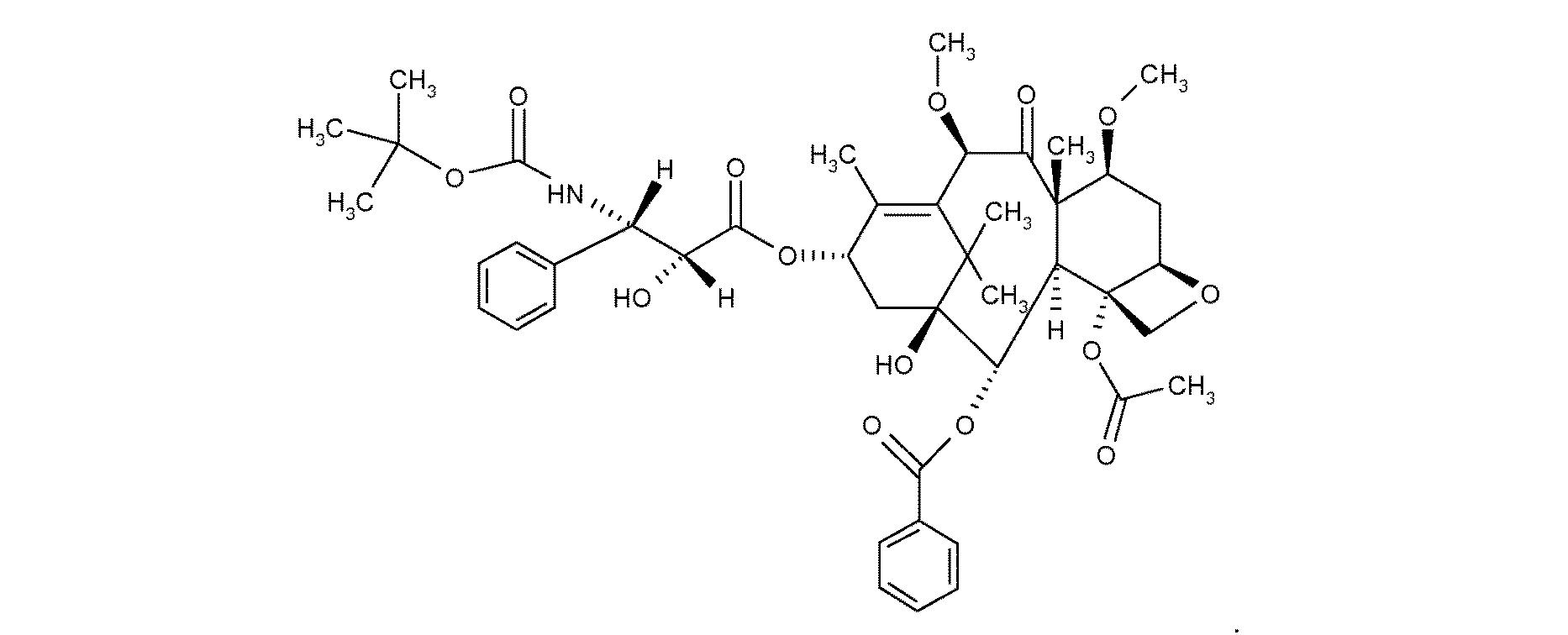
式:
【化1】
の化合物を含む、進行性転移性前立腺癌を治療するための薬学的組成物であって、
化合物が塩基形態、水和物形態または溶媒和物の形態であってよく、化合物がプレドニゾンまたはプレドニゾロンと組み合わせられ、前立腺癌が去勢抵抗性前立腺癌またはホルモン不応性前立腺癌である、前記組成物。

特許第5566466号に係る特許権は6日だけはいえ存続期間延長登録が認められたという事実は、当該特許権がジェブタナ®点滴静注60mgの「効能又は効果」又は「用法及び用量」(効能効果等)を保護する特許権であると特許庁が認定したことになるわけですから、厚労省が当該特許の存在を理由にパテントリンケージを発動しない理由はなさそうです。しかし、後発メーカーからの当該特許に対する無効審判請求の動きもなく、後発医薬品の申請事実も知り得ない、という状況で、透明性の無い日本のパテントリンケージ制度のもとでは、「厚労省が特許権の効力を果たして正しく判断できるかどうか疑わしい・・・まさか厚労省は後発医薬品の承認をしないよね・・・」とサノフィが厚労省判断にも疑心暗鬼となっていることは容易に想像できます。
なお、物質特許第2941951号に係る特許権は、存続期間延長登録(+5年)されましたが、2021年3月25日に満了しています。
また、アセトン溶媒和物の結晶特許第5010279号に係る特許権は、存続期間延長登録(+2年25日)され、存続期間満了日は2026年10月11日となっています。
また、製造方法特許4359386号に係る特許権は、存続期間延長登録もされましたが、年金不納により抹消されています。
関連情報:
- 2023.02.03 Sanofi Fourth quarter and full year 2022 results Press Release: Strong sales performance and double digit EPS growth marking the achievement of the 2022 profitability milestone
Fourth-quarter Jevtana® sales decreased 24.5% to €87 million due to the entry of generic competition in Europe at the end of March 2021 and lower sales in the U.S., reflecting increased competition. In the U.S., Jevtana® is currently covered by four Orange Book listed patents US 7,241,907, US 8,927,592, US 10,583,110 and US 10,716,777. Sanofi filed patent infringement suits under Hatch-Waxman against generic filers asserting the ‘110 patent, the ‘777 patent and the ‘592 patent in the US District Court for the District of Delaware. Sanofi has reached settlement agreements with most of the defendants and the suit against the only remaining defendant Sandoz is ongoing. In August 2022, the district court dismissed Sanofi’s infringement claim related to the ‘592 patent. A 3-day trial took place on January 11-13 2023 and Sandoz has agreed not to launch any generic cabazitaxel product until the earlier of a district court decision in favor of Sandoz or four months after the completion of the post-trial briefing.


コメント
2023年11月20日、サノフィ株式会社による「カバジタキセル(ジェブタナ®)に関する特許権について」の謹告文が掲載されました(日刊薬業: 【謹告】カバジタキセル(ジェブタナⓇ)に関する特許権について)
https://nk.jiho.jp/adtext/185582
【追記】
2023年11月20日、サノフィ株式会社による「カバジタキセル(ジェブタナⓇ)に関する特許権について」の謹告文が掲載されましたが、水和物/無水物の違いについて延長された特許権の効力が及ぶか否か判断できない厚労省のパテントリンケージ運用の問題として注目を浴びた下記事件と同様の問題を孕んでいるかもしれません。
2023.11.29記事: BMS スプリセル®錠(一般名:ダサチニブ水和物)の後発品を巡る特許権侵害訴訟で東京地裁が沢井製薬のダサチニブ錠の製造販売行為を禁止する仮処分命令を発出 ― 本当の問題点 ―
https://www.tokkyoteki.com/2023/11/bms-dasatinib-hydrate-sawai-2.html