2022年1月12日、UCB S.A.、LTS Lohmann Therapie-System AG及び大塚製薬株式会社より「ロチゴチン経皮吸収型製剤に関する特許権について」の謹告文が掲載されました(2022.01.12 日刊薬業【謹告】ロチゴチン経皮吸収型製剤に関する特許権について)。
UCB S.A.はロチゴチン経皮吸収型製剤「ニュープロ®パッチ2.25mg」、「ニュープロ®パッチ4.5mg」、「ニュープロ®パッチ9mg」、「ニュープロ®パッチ13.5mg」及び「ニュープロ®パッチ18mg」を開発し、大塚製薬株式会社は日本における製造販売権を取得しております。
UCB S.A.及びその子会社並びにLTS Lohmann Therapie-System AGは、ロチゴチン経皮吸収型製剤に関する以下の特許権の保有者です。
UCB S.A.及びその子会社の保有する特許権
特許第3984785号、特許第4837915号、特許第4837916号、特許第5026656号、特許第5253707号、特許第5391204号、特許第5564469号、特許第5815556号、特許6335790号
LTS Lohmann Therapie-System AGの保有する特許権
特許第4921371号、特許第5837883号、特許第6161668号、特許第6301356号、特許第6374566号、特許第6573913号、特許第6895755号、特許第6599899号、特許6820391号
大塚製薬株式会社は上記特許権の専用実施権者又は日本における独占的通常実施権者であります。
上記特許権は有効に存続しており、かつその特許請求の範囲に記載された発明の実施を伴うロチゴチン経皮吸収型製剤の製造、販売、輸入等は上記特許権の侵害となり得ることをご承知おき下さい。
UCB S.A.、LTS Lohmann Therapie-System AG及び大塚製薬株式会社は、上記特許権及び専用実施権並びに独占的通常実施権を侵害する行為、または侵害するおそれのある行為に対しましては、厳正なる法的処置を講じる所存です。
ロチゴチン経皮吸収型製剤の製造、販売、輸入等を計画されている企業におかれましては、上記特許権の侵害となる行為を行わないよう、十分ご留意いただきたくお知らせ申し上げます。
– 2022.01.12 日刊薬業「【謹告】ロチゴチン経皮吸収型製剤に関する特許権について」より
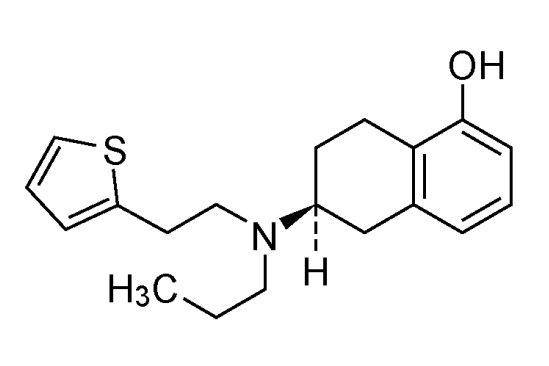
ニュープロ®パッチは、ドイツのSchwarz Pharma社(現UCB社)で開発された、非麦角系構造を有するドパミン受容体作動薬ロチゴチン(Rotigotine)を有効成分とする経皮吸収型製剤(貼付剤)です。
パーキンソン病に対する治療薬として2006年2月に欧州連合(EU)で、2007年5月に米国で承認されました。また、特発性レストレスレッグス症候群治療薬としては2008年8月にEUで、2012年4月に米国で承認されました。
日本においては、2002年に日本国内における「ニュープロパッチ」の独占的開発・販売権をUCB社から取得した大塚製薬株式会社が国内臨床試験を実施し、本剤のパーキンソン病及び中等度から高度の特発性レストレスレッグス症候群(下肢静止不能症候群)に対する有効性及び安全性を確認し、2012年12月25日、ニュープロ®パッチ2.25 mg・4.5 mg・9 mg・13.5 mgの製造販売承認を得ました。さらに、2016年3月22日、ニュープロ®パッチ18mgの製造販売承認も取得しました。
ニュープロ®パッチの売上収益
2021年第3四半期(1-9月)売上収益(日本)は85億円(対前年同期増減率△11.6%)であり、通期は110億円を見込んでいます(大塚ホールディングスFACT BOOK -2021年度3Q決算 補足資料)。
後発医薬品が初承認となる時期
ニュープロ®パッチの後発医薬品は承認されていません。
謹告文では、UCB S.A.及びその子会社の保有する9件の特許権、LTS Lohmann Therapie-System AGの保有する9件の特許権が有効に存続している旨が示されています。
以下の表にそれら特許権の情報を列挙しました。それらは、ロチゴチンの多形体に関する発明、経皮送達システムに関する発明、固体分散体に係るロチゴチンの安定化方法に関する発明、ポリマーフィルム中の医薬の結晶化を防止する方法に関する発明に係る特許権です。
再審査期間が終了(8年間:2012年12月25日~2020年12月24日)していますので、その終了後、既にニュープロ®パッチの後発医薬品が承認申請されており且つそれら特許権を回避していれば、2022年2月にはニュープロ®パッチの後発医薬品が初承認、同年6月には薬価収載・販売に至る可能性があります。
(1)UCB S.A.及びその子会社の保有する特許権
| No. | 特許番号 | 請求項1 | 存続期間満了日 |
|---|---|---|---|
| 1 | 3984785 | マトリックスの成分に対して不活性の裏当て層と、(-)-5,6,7,8-テトラヒドロ-6-[プロピル-[2-(2-チエニル)エチル]アミノ]-1-ナフトールを含有する自己接着性マトリックス層と、使用前に取り外す保護層を含む貼付剤である経皮治療システムであって、前記マトリックス層は、 a)非水溶性、アクリレート系またはシリコン系のポリマー接着剤システムを基剤とし、b)遊離塩基(-)-5,6,7,8-テトラヒドロ-6-[プロピル-[2-(2-チエニル)エチル]アミノ]-1-ナフトールの溶解度が5%(w/w)以上であり、 c)効果的な量の遊離塩基(-)-5,6,7,8-テトラヒドロ-6-[プロピル-[2-(2-チエニル)エチル]アミノ]-1-ナフトールを含むことを特徴とする経皮治療システム。 | 2024/03/18 |
| 2 | 4837915 | マトリクスの成分に対して不活性な支持体層、アミン官能性薬剤を含有する粘着性マトリクスおよび使用前に取り除くべき保護箔または保護シートを有する経皮送達システム(TDS)において、 粘着性マトリクスが、BIO-PSA Q7-4301とBIO-PSA Q7-4201とのブレンドであって、 (1)その際、アミン官能性薬剤がその遊離塩基の形で混合されており、 (2)アミン官能性薬剤で飽和され、かつ前記薬剤をマトリクスの範囲内の多数のミクロ貯留層として含有し、 (3)上記ポリマーがアミン官能性薬剤の遊離塩基に対して透過性であり、 (4)上記ポリマーがアミン官能性薬剤のプロトン化された形に対して不透過性であり、 (5)その際、ミクロ貯留層の最大直径がマトリクスの厚さを下廻ることを特徴とする、経皮送達システム(TDS)。 | 2024/10/15 |
| 3 | 4837916 | マトリクスの成分に対して不活性な支持体層、ロチゴチンを含有する粘着性マトリクスおよび使用前に取り除くべき保護箔または保護シートを有する経皮送達システム(TDS)において、 粘着性マトリクスが、固体または半固体のポリマーから成るものであって、 (1)その際、ロチゴチンがその遊離塩基の形で混合されており、 (2)ロチゴチンで飽和され、かつ前記薬剤をマトリクスの範囲内の多数のミクロ貯留層として含有し、 (3)上記ポリマーがロチゴチンの遊離塩基に対して透過性であり、 (4)上記ポリマーがロチゴチンのプロトン化された形に対して不透過性であり、 (5)その際、ミクロ貯留層の最大直径がマトリクスの厚さを下廻り、該最大直径が、最も大きいものである一つの寸法(x-、y-またはz-寸法)でのミクロ貯留層の直径であることを特徴とする、経皮送達システム。 | 2024/10/15 |
| 4 | 5026656 | 接着成分として少なくとも1種のアミン耐性高粘着性シリコーン圧力感受性接着剤および少なくとも1種のアミン耐性中程度の粘着性シリコーン圧力感受性接着剤の混合物を含み、10~40cm2の大きさを有し、かつ、活性成分として遊離塩基形態のロチゴチンを0.1~3.15mg/cm2含有するシリコーンを基剤とし、投与後24時間において、対象における0.4~2ng/mlのロチゴチンの平均血漿濃度を誘導するのに適したシリコーンを基剤とする経皮吸収治療システムであって、該アミン耐性高粘着性シリコーン圧力感受性接着剤および該アミン耐性中程度の粘着性シリコーン圧力感受性接着剤が、可溶性の重縮合ポリジメチルシロキサン(PDMS)/樹脂網状構造を形成するタイプであり、そのヒドロキシ末端基が、トリメチルシリル(TMS)でキャップされているものである、経皮吸収治療システム。 | 2022/10/31 |
| 5 | 5253707 | マトリックスの成分に対して不活性のバッキング層、(-)-5,6,7,8-テトラヒドロ-6-[プロピル[2-(チエニル)エチル]アミノ]-1-ネフトールを含有している自己接着性のマトリックス層及び使用前に除去すべき保護フィルムを有している、レストレスレッグス症候群の経外角的処置のための経皮吸収治療システム(TDS)であって、マトリックス層が、 a)ベースとしてシリコーンベースの非水性ポリマー接着剤であって、少なくとも1つの強接着性のシリコーン接着剤及び少なくとも1つの中程度の接着性のシリコーン接着剤の混合物を含有し、 b)≧5%(g/g)の遊離塩基(-)-5,6,7,8-テトラヒドロ-6-[プロピル[2-(チエニル)エチル]アミノ]-1-ネフトールの溶解度を有し、および c)遊離塩基(-)-5,6,7,8-テトラヒドロ-6-[プロピル[2-(チエニル)エチル]アミノ]-1-ネフトールを有効量で含有する ことを特徴とする、経皮吸収治療システム(TDS)。 | 2023/05/05 |
| 6 | 5391204 | 下記°2θアングル(±0.2):12.04、13.68、17.72、19.01のピークを含むX線粉末回折スペクトルを有するロチゴチンの多形体。 | 2028/11/25 |
| 7 | 5564469 | マトリクスの成分に対して不活性な支持体層、ロチゴチンを含有する粘着性マトリクスおよび使用前に取り除くべき保護箔または保護シートを有する経皮送達システム(TDS)であって、 粘着性マトリクスが、固体または半固体のポリマーから成るものであって、ポリシロキサンおよび樹脂を含有する2種のシリコーン系感圧接着剤を含むものであり、この2種類のシリコーン系感圧接着剤がお互いに異なるタック特性を有するものであり、 (1)その際、ロチゴチンがその遊離塩基の形で混合されており、 (2)ロチゴチンで飽和され、かつ該ロチゴチンをマトリクスの範囲内の多数のミクロ貯留層として含有し、 (3)上記ポリマーがロチゴチンの遊離塩基に対して透過性であり、 (4)上記ポリマーがロチゴチンのプロトン化された形に対して不透過性であり、 (5)その際、ミクロ貯留層の最大直径がマトリクスの厚さを下廻り、該最大直径が、最も大きいものである一つの寸法(x-、y-またはz-寸法)でのミクロ貯留層の直径である ことを特徴とする、経皮送達システム。 | 2023/07/28 |
| 8 | 5815556 | 分散剤および分散相を含み、該分散相がポリビニルピロリドンおよび非結晶形態のロチゴチンを含む、固体分散体を提供する工程を含み、 ここで、固体分散体は、分散剤と、該分散剤と混和しない分散相とからなる準安定性システムであり、分散剤は、40と250MPの間の複素粘度を有する少なくとも1種の粘着剤を含み、ロチゴチンのポリビニルピロリドンに対する重量割合が9:3.5から9:6の範囲にあり、ロチゴチンがロチゴチン遊離塩基であり、ロチゴチンの分散剤中溶解度が1重量%未満であり、ロチゴチンおよびポリビニルピロリドンが多数のマイクロリザバー中に含まれる、ロチゴチンの安定化方法。 | 2030/12/22 |
| 9 | 6335790 | 活性物質に不透過性である裏打ち層、一つ、二つ又はそれ以上の層から成るマトリックス、及び、取り外し可能な保護層を含んで成る経皮治療システム(TTS)であって、 一つ又は複数のマトリックス層、又はマトリックス層の少なくとも一つは、少なくとも一つの感圧接着剤、少なくとも一つの薬物、並びに架橋ポリビニルピロリドンの粒子を含み、そして 一つ又は複数の薬物含有マトリックス層の製造中に及び/又は活性物質に対して不透過性である、経皮治療システムの裏打ち層のコーティング中に、一つ又は複数の薬物の安定な改質体の融点又は溶融範囲を超える、好ましくは、融点又は溶融範囲を少なくとも10℃超える温度で、1分から10分の継続時間、熱処理が行われ、 該感圧接着剤はホットメルト感圧接着剤であり、該ホットメルト感圧接着剤が、ポリジメチルシロキサンから形成されるシリコーンポリマーを含有するシリコーンホットメルト感圧接着剤であり、そして 一つ又は複数のマトリックス層に対する薬物含有ホットメルト感圧粘着剤が溶媒なしで製造され、 一つ又は複数の薬物、並びに架橋ポリビニルピロリドンの粒子が、複数のマイクロリザーバ中に存在する ことを特徴とする、上記経皮治療システム。 | 2032/12/28 |
(2)LTS Lohmann Therapie-System AGの保有する特許権
| No. | 特許番号 | 請求項1 | 存続期間満了日 |
|---|---|---|---|
| 1 | 4921371 | 支持体層(1)と、支持体層(1)と接触していて、シリコーン接着剤を含むポリマー層(2)と、ポリマー層(2)と接触する取り外し可能な保護層(3)とを含み、支持体層(1)の接触面がシリコン処理によって得た接着剤層(4)を備えており、接着剤層(4)が支持体層にしっかりと固定され、そしてビニル基を含有するオルガノポリシロキサン類とSi-H基を含有するオルガノポリシロキサン類とを含む経皮治療システム(5)。 | 2025/09/06 |
| 2 | 5837883 | ポリマーフィルム中の医薬の結晶化を防止する方法であって、 該ポリマーフィルムは、溶媒又は溶媒混合物、マトリクス形成ポリマー又はマトリクス形成ポリマー混合物、及び溶解形態で存在するロチゴチンを含むコーティング材で基材がコーティングされる工程により形成され、 マトリクス形成ポリマー又は少なくとも1つのマトリクス形成ポリマー混合物のポリマーがポリシロキサン、ポリイソブチレン、及びブロックコポリマーからなる群より選択され、 溶媒又は溶媒混合物は、加熱を適用する乾燥工程でコーティング材から除去され、 該乾燥工程は、コーティング材中に存在するロチゴチンの融点より10~25℃上回る温度で15分を超えない時間、コーティング材を乾燥することを含むものであることを特徴とする、上記方法。 | 2030/10/26 |
| 3 | 6161668 | ポリマーフィルム中の医薬の結晶化を防止する方法であって、 該ポリマーフィルムは、溶媒又は溶媒混合物、マトリクス形成ポリマー又はマトリクス形成ポリマー混合物、及び溶解形態で存在する少なくとも1つの医薬を含むコーティング材で基材がコーティングされる工程により形成され、 マトリクス形成ポリマー又は少なくとも1つのマトリクス形成ポリマー混合物のポリマーがポリシロキサン、ポリイソブチレン、及びブロックコポリマーからなる群より選択され、 溶媒又は溶媒混合物は、加熱を適用する乾燥工程でコーティング材から除去され、 該乾燥工程は、コーティング材中に存在する医薬の融点より10~25℃上回る温度で1~15分間、コーティング材を乾燥することを含むものであり、乾燥工程後にさらなる熱処理を要しないこと を特徴とする、上記方法。 | 2030/10/26 |
| 4 | 6301356 | (a)裏当て層、 (b)ロチゴチンを活性成分として含有する溶媒ベースの自己粘着性マトリックス層、及び (c)放出ライナー を含む経皮治療システムであって、 自己粘着性マトリックス層が、約75~400g/m2のコーティング重量を有し、リザーバー層の重量に対して約9~25重量%のロチゴチンを含有するリザーバー層を含む、上記経皮治療システム。 | 2033/11/21 |
| 5 | 6374566 | ポリマーフィルム中の融点が120℃未満の医薬の結晶化を防止する方法であって、 該ポリマーフィルムは、溶媒又は溶媒混合物、マトリクス形成ポリマー又はマトリクス形成ポリマー混合物、及び溶解形態で存在するロチゴチンを含むコーティング材で基材がコーティングされる工程により形成され、 マトリクス形成ポリマー又は少なくとも1つのマトリクス形成ポリマー混合物のポリマーがポリシロキサン、ポリイソブチレン、及びブロックコポリマーからなる群より選択され、 溶媒又は溶媒混合物は、加熱を適用する乾燥工程でコーティング材から除去され、 該乾燥工程は、コーティング材中に存在するロチゴチンの融点より10~25℃上回る温度でコーティング材を乾燥することを含むものであり、乾燥工程後に更なる熱処理を要しないことを特徴とする、上記方法。 | 2030/10/26 |
| 6 | 6573913 | 自己接着性層構造中に治療有効量のロチゴチン塩基を含む、ロチゴチンの経皮投与のための経皮治療システムであって、該自己接着性層構造が A)裏打ち層、ならびに B)ロチゴチン含有二相層であって、該二相層が a)75%~100%のポリマーまたはポリマー混合物を含む組成物を有する外部相と、 b)ロチゴチン塩基を含む組成物を有する内部相と を有し、 該内部相が該外部相中に分散したデポジットを形成し、 該内部相が i.ロチゴチン塩基と、 ii.ポリマー群: - 少なくとも80のK値を有するポリビニルピロリドン、 - 80未満のK値を有するポリビニルピロリドン、 - ビニルカプロラクタム、酢酸ビニルおよびエチレングリコールのコポリマー、 - ビニルピロリドンおよび酢酸ビニルのコポリマー、 - エチレンおよび酢酸ビニルのコポリマー、 - ポリエチレングリコール、 - ポリプロピレングリコール、 - アクリルポリマー、 - 変性セルロース のうちの少なくとも2つから選択される少なくとも2つの親水性ポリマーを含むポリマー混合物と を含み、 内部相中のポリマー混合物が、前記ロチゴチン塩基が内部相中のポリマー混合物と固溶体を形成するために十分な量で存在する、 前記ロチゴチン含有二相層、 ならびに C)場合により、追加の皮膚接触層 を含む、前記経皮治療システム。 | 2035/05/20 |
| 7 | 6895755 | 二相層中における活性薬剤の濃度に依存しない様式で活性薬剤の透過速度を制御するための、親水性内部相および疎水性外部相を有する乾燥された二相層の形態の活性薬剤含有層を有する経皮治療システムにおけるポリビニルピロリドンからなる添加剤の使用であって、 該内部相が該添加剤およびその中に溶解している活性薬剤を1:0.4~1:0.6の活性薬剤と添加剤の比で含み、 該添加剤が該活性薬剤よりも水に対して高い親和性を有し、 該二相層中の活性薬剤の量に比例して透過速度が維持される、前記使用。 | 2035/05/20 |
| 8 | 6599899 | 自己接着性層構造を含む全身性活性薬剤の経皮投与のための経皮治療システムであって、該自己接着性層構造が A)裏打ち層、ならびに B)乾燥二相層であって、該乾燥二相層が a)75%~100%のポリマーまたはポリマー混合物を含む組成物を有する外部相と、 b)少なくとも1つの活性薬剤を含む組成物を有する内部相であって、 該内部相が該外部相中に分散したデポジットを形成する前記内部相と、 c)25℃において10cSt~100000cStの動粘性率を有する0.1%~1.5%の界面介在物であって、該界面介在物はシリコーンオイルである、前記界面介在物と を有する前記乾燥二相層、 ならびに C)場合により、追加の皮膚接触層 を含む、前記経皮治療システム。 | 2035/05/20 |
| 9 | 6820391 | 自己接着性層構造を含む全身性活性薬剤の経皮投与のための経皮治療システムであって、該自己接着性層構造が A)裏打ち層、ならびに B)乾燥二相層であって、該乾燥二相層が a)75%~100%のポリマーまたはポリマー混合物を含む組成物を有する外部相と、 b)少なくとも1つの活性薬剤を含む組成物を有する内部相であって、 該内部相が該外部相中に分散したデポジットを形成する前記内部相と、 c)25℃において10cSt~100000cStの動粘性率を有する0.1%~2%の界面介在物であって、ただし0.1%~1.5%の範囲の界面介在物は除き、該界面介在物はシリコーンオイルである、前記界面介在物と を有する前記乾燥二相層、 ならびに C)場合により、追加の皮膚接触層 を含む、前記経皮治療システム。 | 2035/05/20 |

コメント