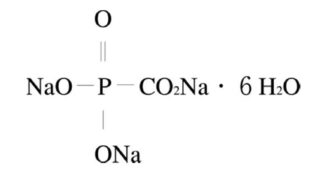
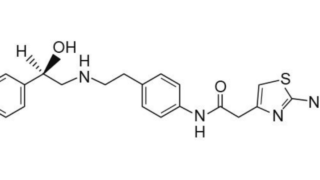
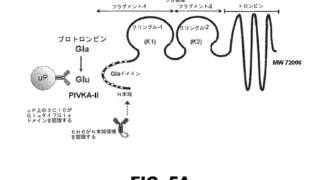
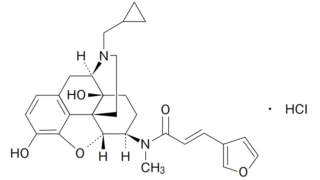
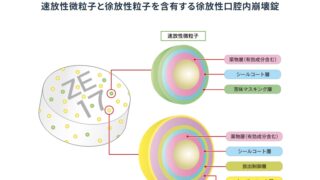
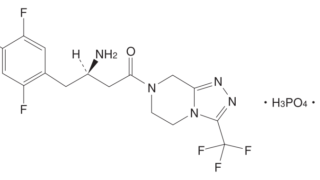
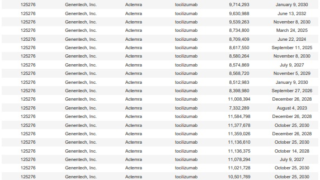
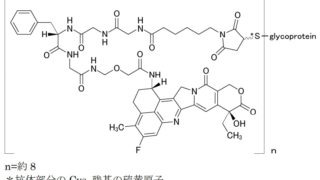
*Topics
*Topics 【更新:GW中のひとときにいかがですか】noteにて最新記事を先行公開中
noteにて、ブログ最新記事を先行してご覧頂けるよう試験的な運用を開始しております。 珈琲☕一杯分(ワンコイン)でちょっと一息。 暇つぶしにいかがでしょうか。 一定期間経過してから記事は無料閲覧可能なこの「医薬系"特許的"判例」ブログ上で公開されますが、一足先に最新記事を閲覧できます。 New! 2024.04.28 転載記事(無料): New! 2024.04.28 先行公開記事: New! 2...