2025年の医薬系“特許的”な出来事を振り返ります。

2025年も残すところあとわずかとなりました。
2025年の医薬系“特許的”な世相を漢字一文字で表すとしたら、何を思い浮かべますか?

わたくしは「延」ですね。存続期間延長をめぐる事件がいくつもありましたし、製薬業界では大きな話題になりました。

確かに! 医薬系特許的な世界では、パテントリンケージ制度の根本的な課題についての議論も“延び延び”になっているようだし、延長効力の解釈議論や医薬品データ保護制度の導入議論も“延長戦”が続いてる感じだ!

さすがピポ先輩、例えが冴えてます~! でも、2025年は「延」じゃないようですよ。
このブログは、製薬業界の舞台裏で繰り広げられている知的財産に関する事件を紹介しつつ、最新のトレンドを知的財産の視点で紐解きます。
ご興味あれば、ぜひ、当ブログ(https://www.tokkyoteki.com)とX(旧Twitter)(@tokkyoteki)のフォローをどうぞよろしくお願いします。

・・・ということで、いきなり発表しちゃいます。
2025年の医薬系“特許的”な世相を表す漢字一文字、“漢字・オブ・ザ・イヤー”は・・・
・
・
・

なるほどです。

えっ、「実」!? そうか、ピポの出願が特許になって、実を結んだ実績と実力が認められたんだな! 偉いだろ!

「実るほど頭を垂れる稲穂かな」ですよ~ピポ先輩。

……。
皆さまはどんな一文字を思い浮かべたでしょうか。
本記事では、「実」をテーマに、2025年を賑わせた医薬系“特許的”な出来事について、振り返ります。
はじめに
知的財産の営みとは、無体物に独占的な法的保護を与え、それを有体物を通じて社会に実現していく活動であると同時に、技術的思想の意味や実世界での具体化のあり方をめぐる境界線の攻防でもあります。そして、その境界線を常に問い直していく営為そのものでもあります。
こうした境界線は決して安定したものではありません。技術の進展に加え、公益性、AI、クロスボーダーといった要素が絡み合うことで、思いもよらぬかたちで揺らぎ、しばしば紛争として顕在化してきています。
私たちは、この「不確実」な境界の狭間で、ビジネス面ではいかに「現実的」な対応と「着実」な成果を導くか、政策面ではいかに予見可能性を高める「実効性」ある仕組みを築くかという課題に直面し続けています。
振り返れば、2025年の議論や判決の随所に、「不確実」や「実効性」といった言葉に象徴される「実」という文字が繰り返し浮かび上がってきました。
それぞれの局面で顔をのぞかせた「実」は、知的財産の営みが本質的に抱える境界線の揺らぎと可能性を映し出していたように思われます。
それでは、今年を彩った多様な「実」にまつわる論点を振り返っていきましょう。
1.延長効力の「実質同一」
2025年を振り返ると、存続期間延長制度の核心をなす「実質的に同一」判断が、かつてない注目を集めました。
中でも最も注目を集めたのは、そう痒症改善剤レミッチ®の後発医薬品(ナルフラフィン塩酸塩OD錠)をめぐり、東レが特許権侵害を主張した事件です。被告となった沢井製薬と扶桑薬品工業に対し、知財高裁は2025年5月27日、侵害を認め、沢井製薬に142億9,093万9,291円、扶桑薬品工業に74億7,287万8,838円という巨額の損害賠償を命じました(2025.08.16ブログ記事「2025.05.27 「東レ v. 沢井・扶桑」 知財高裁令和3年(ネ)10037 ― 延長特許権の効力が争われたナルフラフィン(レミッチ®OD錠)事件判決(侵害論についての雑感)」参照)。

最大の争点の一つは、延長特許権の効力が被告製剤に及ぶかどうかでした。知財高裁は、特許発明の技術的意義や処分内容に照らし、「医薬品として実質同一」と認められる範囲に効力が及ぶと判断しました。具体的には、ナルフラフィンを有効成分とする止痒剤という技術的特徴や作用効果、剤形はいずれも同一であり、添加剤の差異は有効成分の効果を妨げない形式的な相違に過ぎないと位置付けました。その結果、被告製剤は原告製剤と「実質同一」とされ、延長特許権の効力が及ぶと結論づけられたのです。
この判断は、医薬用途発明に係る延長特許権の効力範囲について、知財高裁が初めて真正面から示したものであり、制度運用における重要なマイルストーンといえます。オキサリプラティヌム事件大合議判決(2017.01.22ブログ記事「2017.01.20 「デビオファーム v. 東和薬品」 知財高裁平成28年(ネ)10046」参照)が提示した規範を踏まえつつ、その適用範囲を用途発明にも拡張した点に意義があります。「実質同一」該当性の判断に柔軟な解釈枠組みを与えたことは、制度趣旨に即した妥当な方向性と評価できるでしょう。
とりわけ、添加剤の違いを理由に効力を否定すれば、後発メーカーによる形式的な回避を許すことになりかねません。今回の判断は、その懸念を的確に押さえ、延長制度の実効性を確保する観点からも高く評価されます。
もっとも、境界線をめぐる不明確さが解消されたわけではありません。今後の事案では、特許発明の技術的意義や作用効果をどのように比較検討するか、その具体的な適用方法次第で再び対立が生じる可能性が残されています。したがって、事例の蓄積を通じて判断基準を洗練させていくことが不可欠です。
延長特許権の効力範囲について明確な基準が確立されれば、先発・後発を問わず業界全体の予見可能性が高まり、開発投資や参入判断の健全化につながるでしょう。今回の判決はその第一歩であり、将来的には最高裁による判断も含め、より体系的な法理の確立へとつながっていくことが期待されます。
あわせて2025年には、「実質同一」の論点ではありませんが存続期間延長制度の運用に関してもう一つ示唆的な判決がありました。ロシュが「ガザイバ®点滴静注1000mg」の添付文書改訂に関する情報がPMDAウェブサイトに掲載された日を「処分を受けた日」と主張して延長登録を求めた事案です(2025.05.26ブログ記事「2025.05.26 「エフ・ホフマン―ラ・ロシュ v. 国」 知財高裁令和6年(行コ)10007 ― 特許権の存続期間の延長登録が認められる「処分」の対象」参照)。

ロシュは、添付文書改訂は実質的に一部変更承認と同等であり、PMDAの「助言」も事実上強制力を伴うと主張しました。しかし知財高裁は、添付文書の改訂は承認の対象外であり、「助言」も行政指導にとどまると判断し、原判決(請求棄却)を支持しました。本件は、添付文書改訂や行政指導に基づく事実を延長理由とすることの限界を明確に示したものといえます。
2.PCSK9抗体事件の「実施例」
2025年は、抗体に関する機能的クレームのサポート要件をめぐる事件で、その発明の技術的意義と解決手段との関係性を裏付ける合理的なメカニズムの開示が不可欠であることが判示され、その開示をいかに「実施例」で支えるかも重要であることを改めて考えさせられた一年でもありました。
抗PCSK9抗体をめぐる特許権侵害訴訟で、知財高裁は2025年4月16日、アムジェンの特許が特許法36条6項1号(サポート要件)に違反すると判断し、請求棄却とした原判決を維持しました。結果として、アムジェンは敗訴しました(2025.06.11ブログ記事「2025.04.16 「アムジェン v. サノフィ」 知財高裁令和5年(ネ)10107 ― 機能的クレームにおけるサポート要件の適用と無効理由の再主張の可否 ―」参照)。
争点となったのは、「参照抗体と競合し、PCSK9とLDLRの結合を中和する抗体」という機能的に表現されたクレームです。その裏付けとして、明細書に合理的記載があるか否かが審理の中心となりました。
知財高裁は、抗体が参照抗体と競合するという事実から直ちに「中和」機能を導けるわけではないと指摘しました。特に、「EGFaミミック抗体」という原審の限定的な議論にとどまらず、「競合」と「中和」の関係自体が不明確である点を強調し、サポート要件違反を認定した点に特色があります。
米国でも実施可能性欠如を理由に無効とされ(2023.05.19ブログ記事 「【速報】2023.05.18 「Amgen v. Sanofi」 米国最高裁No. 21–757 - Amgenの抗PCSK9抗体特許 実施可能要件非充足を理由に無効としたCAFC判決を米国最高裁も支持 -」(『医薬系特許的判例ブログ年報 2023』 Fubuki著 2024年5月発行, p180-182)参照)、さらに機能的クレームの実施可能性を厳格に問う潮流が別件でも確認されています(2023.10.13ブログ記事「機能的表現抗体クレイムの終焉か ―Amgen事件米国最高裁判決を受けBaxalta社の抗体特許を無効とする判決(Baxalta v. Genentech CAFC 2022-1461)―」(『医薬系特許的判例ブログ年報 2023』 Fubuki著 2024年5月発行, p222-229)参照)。
日米ともに、合理的なメカニズムや実施可能性を示すにはやはり適切な「実施例」を伴わなければ権利を維持できないという現実を突き付けた点で、実務上の大きな意義を持つものだったといえるでしょう。
しかし、欧州では日米とは異なる判決が下されました。
2025年11月25日、欧州統一特許裁判所(Unified Patent Court、以下「UPC」)控訴裁判所は、中央部ミュンヘン支部(第一審)が無効と判断したアムジェンの特許につき、これを覆し有効と判断しました(2025.11.29ブログ記事「UPC控訴裁、AmgenのPCSK9抗体特許を有効と判断(2025.11.25 Amgen v. Sanofi UPC_CoA_528/2024; UPC_CoA_529/2024)」参照)。
UPC控訴裁判所は、発明の開示要件(EPC第83条)について、機能的に表現されたクレームの一部の「実施例」が利用不可能であっても、開示を通じて当業者により請求項の範囲内で適切な「実施例」が得られる限り、開示の十分性には影響しないとし、当業者が合理的な試行錯誤の範囲内で実施可能な限り要件は充足すると指摘しました。
これまで、抗体医薬を含むバイオ医薬品の分野では、機能的に表現されたクレームによって広範な権利範囲を確保し、先行的に特許を押さえて競争優位やライセンス収益につなげる戦略が主流でした。しかし、米・日とUPCの判断枠組みの差異が鮮明になってきたことで、機能的表現クレームを活用して競争優位を確保しようとする企業は、国・制度ごとの特許無効リスクを踏まえた対策や戦略立案が一層求められるようになってきたといえるでしょう。
3.CRISPR/Cas9と「実験」の成功
「実験」の必要性をいかに法的に評価するかは、ライフサイエンス分野における知財実務の大きな課題であり続けています。2025年も、その最前線を象徴する事件がありました。
ゲノム編集技術CRISPR/Cas9に関する特許をめぐり、ツールゲンが無効審判請求の不成立審決の取消しを求めた訴訟です。2025年6月26日、知財高裁は、真核細胞への適用に関する発明について、優先基礎出願の記載と当時の技術常識を踏まえれば十分な開示があったと認定し、優先権の有効性を肯定して原告の請求を棄却しました(2025.08.31ブログ記事「2025.06.26 「ツールゲン v. カリフォルニア大学 他」 知財高裁令和5年(行ケ)10147 ― ゲノム編集技術CRISPR/Cas9に関する特許発明を巡る争い」参照)。

注目すべきは、「実験の成功」の位置づけです。すなわち、出願時点では真核細胞における具体的な実施例が明示されていなかったにもかかわらず、その後まもなく第三者研究者が実施に成功したという事実を、当時の技術常識を裏付ける間接的証拠として評価した点です。知財高裁は、後日の「実験の成功」を優先日当時の実施可能性を補強するものとして認めたといえます。
従来、発明の開示要件や優先権主張の有効性は、出願書類の記載と出願時の技術常識に基づき、厳格に判断されるのが原則でした。そこに本判決のような「後発的成功例」を補強的に取り込む解釈が現れたことは、発明の実施可能性の理解に新たな含意を与えるものといえるでしょう。ただし、どの範囲まで後発的成功例を証拠として取り込めるのか、その線引きは今後も議論を呼ぶに違いありません。まさに「実験の成功」をめぐる評価が、発明の成立性と特許権の安定性を大きく左右することを示す一件でした。
さらに、この争点は、CRISPR/Cas9技術が「原核細胞から真核細胞へ適用可能である」と確実に認識された時期をめぐる国際的な係争の一断面でもあります。米国においても、旧法下のインターフェアレンス手続で同様の点が争われており、発明成立要件と技術常識との境界をいかに画定するかは、単なる国内問題にとどまらず、グローバルな技術覇権を左右し得る論点であることが改めて浮き彫りになっています。
この紛争の渦中にあるCRISPR/Cas9技術が、2020年ノーベル化学賞を受賞したシャルパンティエ氏およびダウドナ氏による研究成果であることも、象徴的といえるでしょう。
ノーベル賞といえば、2025年には坂口志文(Shimon Sakaguchi)氏にノーベル生理学・医学賞が授与されたことも記憶に新しい朗報でした(2025.10.08ブログ記事「祝・坂口志文氏 ノーベル生理学・医学賞受賞 ― 共有特許から製薬企業とのコラボレーションを紐解く」参照)。
4.引用発明の「実施可能性」と「実証性」
2025年における進歩性判断における注目事例の一つが、引用発明の「実施可能性」をめぐる議論でした。
まず、パーキンソン病治療剤ノウリアスト®(一般名:イストラデフィリン)に関する協和キリンの医薬用途発明特許を対象とした無効審判請求不成立審決の取消訴訟です。知財高裁は、医薬用途発明を引用発明として位置付けるためには、当業者がその用途について「実施可能である」と理解できることが不可欠であると判示しました(2025.04.07ブログ記事「2025.02.13 「東和薬品・共和薬品工業・日医工 v. 協和キリン」 知財高裁令和5年(行ケ)10093・10094 ― 引用発明が医薬用途発明として認定されるためには ―」参照)。

 特に重要なのは、知財高裁が「可能性がある」「期待できる」「予備的試験で有望な結果が得られた」といった記載だけでは不十分であり、「信頼に足るデータ」によって有用性が裏付けられていなければならないと明確に述べた点です。すなわち、仮説段階や探索的知見だけでは、引用発明としての資格を持たないと判断したのです。
特に重要なのは、知財高裁が「可能性がある」「期待できる」「予備的試験で有望な結果が得られた」といった記載だけでは不十分であり、「信頼に足るデータ」によって有用性が裏付けられていなければならないと明確に述べた点です。すなわち、仮説段階や探索的知見だけでは、引用発明としての資格を持たないと判断したのです。
この見解を踏まえ、知財高裁は審決の一部に誤りを認めつつも、最終的には本件発明には予測困難な顕著な効果があるとして進歩性を肯定しました。結果として、原告らの請求は棄却されました。
本判決は、医薬分野における進歩性判断において、引用発明の「実施可能性」を正面から問う基準を示した点で大きな意味を持ちます。近年、医薬用途発明の進歩性判断においては、引用発明におけるデータの有無やその信頼性を重視する傾向が強まっており(2024.10.28ブログ記事「2024.08.07 「科研製薬 v. リジェネロン/サノフィ」 知財高裁令和5年(行ケ)10019 ― 臨床試験結果に基づく医薬用途発明の特許出願のジレンマ:臨床試験プロトコル公開のインパクト ―」(『医薬系特許的判例ブログ年報 2024』 Fubuki著 2025年3月発行, p198-235)および2023.02.13ブログ記事「2023.01.12 「東和薬品・共和薬品工業・日医工 v. 協和キリン」 令和3年(行ケ)10155, 10157・・・パーキンソン病治療剤ノウリアストの医薬用途発明の特許性 引用文献記載は「実証的でない」と判断」(『医薬系特許的判例ブログ年報 2023』 Fubuki著 2024年5月発行, p28-52)参照)、今後も、引用発明における「信頼に足るデータ」の有無が審判・訴訟の主要な争点となる事案が増えるかもしれません。
5.AI発明と「実務上の課題」
AIは発明者になれるのか。この問いに対して、ついに知財高裁の判断が下されました。一方で、発明者性の問題だけでなく知的財産制度におけるAIの扱いについて「実務上の大きな課題」が浮上するきっかけともなりました。
 いわゆるDABUS事件では、原告(X:控訴人)が「AIが自律的に発明をした」としてPCT出願を行い、日本国内でも手続きを進めました。しかし特許庁長官は、特許法に基づき発明者の氏名を自然人で記載するよう補正を命じ、これに応じなかったため出願は却下。原告は処分取消訴訟を提起しましたが、一審(東京地裁)は請求を棄却しました。
いわゆるDABUS事件では、原告(X:控訴人)が「AIが自律的に発明をした」としてPCT出願を行い、日本国内でも手続きを進めました。しかし特許庁長官は、特許法に基づき発明者の氏名を自然人で記載するよう補正を命じ、これに応じなかったため出願は却下。原告は処分取消訴訟を提起しましたが、一審(東京地裁)は請求を棄却しました。
控訴審である知財高裁も、一歩踏み込んで「発明の概念自体は自然人を発明者とする場合に限られないと解したとしても」と前置きしつつ、特許を受けることができる発明者は自然人とすることを前提に特許制度が組み立てられている以上、AIを発明者とすることはできないと判断しました。結論として、AI発明者説は認められず、出願には必ず自然人を発明者として記載すべきことが明確に示されたのです(2025.02.28ブログ記事「2025.01.30 「X v. 国」 知財高裁令和6年(行コ)10006 ― 「AIは発明者になれず」 知財高裁、特許出願を認めず ―」参照)。

また、2025年11月28日、米国特許商標庁(USPTO)は、AIが関与する発明の発明者認定に関し、新たなガイダンスを連邦官報に公表しました。本通知は、2024年2月13日に発出された先行ガイダンスを全面的に撤回し、従来の法理を明確化する内容となっています(2025.11.29ブログ記事「USPTO、AI支援発明の発明者認定に関する新ガイダンスを発表 ― 2024年2月ガイダンスを全て撤回、改めて「自然人のみ発明者」を強調」参照)。

もっとも、前記DABUS事件判決やUSPTOの発明者認定ガイダンス公表でこれまでの発明者認定の原則は揺るがないことが明確にされたように思えますが、AIが関与することにより生じる知財問題がすべて解決したわけではありません。研究現場ではAIの活用が加速度的に広がり、法制度との間にギャップが拡大するおそれがあります。権利の帰属、発明者の適切な認定、開示要件との整合性、AI生成発明の引用例としての認定の在り方、進歩性判断におけるAI利用の評価、さらには国際調和の在り方など、実務レベルで直面する課題はなお山積しています。
このような背景を受けて、2025年、産業構造審議会知的財産分科会 特許制度小委員会では、「AI技術の発達を踏まえた特許制度上の適切な対応について」の議論が活発に行われています。
6.大合議判決と「医療行為の円滑な実施」
公益と特許権の調和という難題に裁判所が真正面から踏み込んだ事例として注目されたのが、知財高裁大合議による「東海医科 v. Y」事件です。本件は、自己由来の血漿、b-FGF、脂肪乳剤の3成分を含む「豊胸用組成物」に関する特許を有する控訴人が、当該組成物を調合して豊胸手術に用いた医師Yを特許権侵害で訴えたものでした(2025.05.09ブログ記事「2025.03.19 「東海医科 v. Y」 知財高裁大合議令和5年(ネ)10040 ― 美容医療における特許権侵害と特許法69条3項の適用範囲 ―」参照)。

原審・東京地裁は、医師が各成分を個別に投与していたと認定し、侵害を否定しました。しかし知財高裁(大合議)はこれを覆し、医師が3成分を同時に含む組成物を調合し患者に投与していたと認定しました。そのうえで、①本件発明は「物の発明」である以上、人体への投与を理由に特許法29条1項柱書の産業上の利用可能性を否定できないこと、②原材料が人間由来であっても同条違反にはならないことを明示しました。
さらに、問題の組成物は審美目的の美容医療に用いられるものであり、「人の病気の診断、治療、処置又は予防のために使用する物」には当たらないとして、調剤行為に対する特許権侵害の免責を定める特許法69条3項の適用も否定しました。その結果、知財高裁は原判決を取り消し、被控訴人に約1500万円の損害賠償を命じました。
この大合議判決の意義は、医療の場で用いられる「物の発明」について産業上の利用可能性を広く肯定し、美容医療においては調剤行為も特許権侵害となり得ることを明確にした点にあります。
もっとも、本判決は同時に多くの課題を残しました。たとえば、同一技術内容でもクレームを「物の発明」とするか「方法の発明」とするかによって特許の保護範囲や医療行為との関係が大きく変わり得る現行制度の妥当性、人体を介した行為が「発明の実施」と評価されるための要件整理、さらに「医薬」や「病気」という概念の特許法上の理解と現代医学的・社会的通念との整合性などです。また、医療行為の主体や対象技術の性質に応じて、特許法69条の適用範囲をより明確に設計する必要性も浮かび上がりました(2023.09.30 ブログ記事「2023.03.24 「東海医科 v. A」 東京地裁令和4年(ワ)5905 ― 体外と体内の狭間、組み合わせの物と方法の狭間、医療と産業の狭間で ―」(『医薬系特許的判例ブログ年報 2023』 Fubuki著 2024年5月発行, p106-131)参照)。
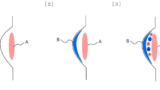
このように、本件は大合議事件として扱われ、医療行為と特許権の関係に関する新たな視座を提示しましたが、「医療の円滑な実施」と知的財産権保護の調和という根本課題は依然として解決されていません。実務家としては、本判決の論理と射程を精緻に理解し、出願戦略、契約実務、操業自由度(FTO)の確保、さらには訴訟対応に至るまで、多角的かつ戦略的に備えを講じることが求められます。
7.パンデミック協定と「実効的な国際協力」
グローバルな健康危機において、知的財産はいかに位置付けられるべきか。この問いは、国際協力と産業保護の両立という難題を内包しています。2025年5月20日、世界保健機関(WHO)の最高意思決定機関である第78回世界保健総会(WHA)は、「WHOパンデミック協定(WHO Pandemic Agreement)」を採択しました。本協定は、COVID-19の教訓を踏まえ、将来のパンデミックへの備えと対応の強化を目的とするものです。その中には、公衆衛生上の公平性、各国主権の尊重、技術移転と知的財産制度との調和といった、しばしば相反する要素が盛り込まれています(2025.05.20ブログ記事「WHO、パンデミック協定を正式採択 ― 公衆衛生と知的財産のバランスを図る国際枠組みが誕生」参照)。

前文では、医薬品アクセスに対する知的財産の影響への懸念が示される一方で、知的財産保護の重要性も明記され、全体的に中立的な立場をとりつつ「実効的な国際協力」を志向する姿勢が表明されました。
さらに本文第12条では、パンデミック発生時の「病原体アクセスと利益配分システム(Pathogen Access and Benefit-Sharing (PABS) System)」が提示され、製薬業界に具体的な貢献を求めています。特に「参加製造業者(participating manufacturers)」は、パンデミック時にWHOに対してリアルタイム生産量の最大20%を迅速に提供する義務を負い、その内訳は10%を無償、10%を低価格で提供することが規定されました。これは、発展途上国などへの公平な医薬品供給を確保する仕組みであり、今後の製造・供給体制や契約・流通スキームに大きな影響を与えると考えられます。
もっとも、こうした制度の具体的設計は今後策定されるPABS附属書(Annex)に委ねられており、政府間交渉は継続されます。日本政府は協定採択を「重要な一歩」と評価しつつ、附属書の議論を引き続き行う方針を示しました。知的財産や製薬分野の専門家にとっては、この附属書の交渉過程と、その国内法制度への反映を注視しながら、産業界としての対応を検討する段階に入ったと言えるでしょう。
パンデミック協定は、公衆衛生のための国際的枠組みであると同時に、産業界にとっては国際的な義務と責任を伴うものです。その運用が成功すれば、真に「実効的な国際協力」となり得ますが、逆に失敗すれば制度への信頼を損なう危険もあります。本協定の行方は、今後の国際的な知財・公衆衛生政策を占う試金石となるでしょう。
8.「裁定通常実施権」の運用改善
公共の利益を確保するためには、裁定制度を形式的に存置するだけでは不十分であり、実効性を伴った柔軟な仕組みとして整備することが求められます。2025年5月30日、特許庁は、裁定制度の円滑な運用を目的とした「裁定制度の運用要領」改正案および審議の効率化を図る「特許法施行規則の一部を改正する省令案」について、意見募集(パブリック・コメント)の結果とそれに対する考え方を公表し、同日付で改正を施行しました(2025.05.30ブログ記事「裁定制度の運用要領および特許法施行規則の改正、省令公布・施行へ ― 特許庁が意見募集結果と考え方を公表」参照)。

今回の改正は、裁定請求の当事者にとっての予見可能性を高め、あわせて工業所有権審議会における審議の効率化を図ることを目的とするものです。その背景には、2021-1号裁定請求、すなわち自家iPS細胞由来網膜色素上皮細胞の製造をめぐりビジョンケア、ヘリオス、住友ファーマ間で和解に至った事案で浮き彫りとなった課題がありました(2024.07.02ブログ記事「公共の利益のための通常実施権を設定すべき旨の裁定請求 ⾃家iPS細胞由来の網膜色素上皮細胞の製造等に関してビジョンケア、ヘリオス、住友ファーマらが和解 ― 強制実施権設定の在り方と浮かび上がった課題 ―」(『医薬系特許的判例ブログ年報 2024』 Fubuki著 2025年3月発行, p171-197)参照)。
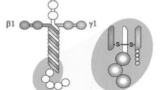
この事案を踏まえ、改正では、事前協議要件を「協議が成立せず、又は協議をすることができないとき」と明確化し、「公共の利益のために特に必要であるとき」という要件の具体的な解釈指針を提示しました。さらに、裁定請求書のフォーマット見直しも行われ、従来残されていた不確実性が一定程度解消されています。
裁定請求は頻繁に生じる手続ではありませんが、「公共の利益のために特に必要であるとき」という境界線は、生命や健康に直結するライフサイエンス産業にとって研究開発や事業化の方向性を左右し得る重大な意味を持ちます。そのため今回の改正は、単なる手続の明確化にとどまらず、実務家や企業にとっての予見可能性を高め、必要に応じて制度を実効的に活用できる環境を整える意義を持つものといえます。
今後は実際の運用を通じて、この改正がどこまで実効性を発揮するかが試されることになります。「裁定通常実施権」が単なる「最後の手段」にとどまらず、公共の利益を確保するための現実的かつ有効な選択肢として機能するよう、制度運用の不断の改善と実務への定着が引き続き求められるでしょう。
9.パテントリンケージと「虚偽の事実の告知」
日本のパテントリンケージ(patent linkage)制度運用において、情報の正確性と透明性が改めて問われたのが、アイリーア®(アフリベルセプト)事件です。本件では、後発メーカーのサムスンが自社のバイオシミラーは特許権を侵害しないと主張する一方、先発品の特許権者であるリジェネロンが厚労省等に対し「特許権侵害に当たる」と情報提供した行為が、不正競争防止法2条1項21号の「虚偽の事実の告知」に該当するかどうかが争われ、サムスンはその情報提供の差止めを求めて仮処分命令を申し立てました。
知財高裁は2025年8月13日の判決で、医薬品承認は薬機法に基づく行政処分であり、一般の取引社会における競争行為とは性質を異にすると指摘しました。また、厚労省が特許権者等に補足説明を求めるのは行政権限の適切な行使の一環にすぎず、その情報が市場に伝播して申請者の経済的評価を低下させるものとはいえないと判示しました。その結果、特許権者による厚労省等への情報提供は不正競争には当たらないとされ、サムスンの抗告は棄却、原決定(却下)が維持されました(2025.09.07ブログ記事「2025.08.13 「サムスン v. リジェネロン」 知財高裁令和7年(ラ)10003 ― アイリーア®(アフリベルセプト)のパテントリンケージにおける特許権者による情報提供と不競法の信用棄損行為該当性」参照)。

本判決により、仮に情報提供行為が不正競争に当たると解されれば運用の根幹が揺らぎかねなかったところ、制度趣旨に即した妥当な判断が示されたと評価できます。
その後、リバーロキサバンを巡り、先発メーカーであるバイエル薬品の特許権に関する情報提供・謹告掲載行為が後発メーカーに対する不正競争防止法上の信用棄損行為に該当するかが争われた事案でもこの知財高裁判決を追随する地裁判決が出されています(2025.12.11ブログ記事「2025.10.29 「日本ジェネリック v. バイエル薬品」 東京地裁令和7年(ワ)70139 ― パテントリンケージ下の情報提供・謹告掲載と不競法上の信用棄損行為該当性」参照)。

他方で、パテントリンケージ制度の運用が依然として不透明である点は、今なお課題として残ります。
2025年8月29日、厚労省は薬事審議会(医薬品第一部会)において、アイリーア®のバイオ後続品2品目の承認を報告しました。そのうち、同年9月19日に承認された富士製薬工業のバイオ後続品では、サムスンのバイオ後続品でパテントリンケージ上問題となり承認されなかった「中心窩下脈絡膜新生血管を伴う加齢黄斑変性(AMD)」が承認される一方で、サムスン品で承認された「糖尿病性黄斑浮腫(DME)」は承認されませんでした(2025.09.19 富士製薬工業 press release: バイオ後続品(バイオシミラー)3製品の製造販売承認取得のお知らせ―アフリベルセプト(遺伝子組換え)・ゴリムマブ(遺伝子組換え)・デノスマブ(遺伝子組換え))。2025年8月26日に登録された特許第7733706号の存在が、富士製薬工業のバイオ後続品における効能効果の承認可否に影響した可能性も指摘されていますが、詳細は明らかではありません。11月12日、先発メーカー(リジェネロン/バイエル)は富士製薬工業のバイオ後続品の製造・販売等の行為が当該特許権に抵触するものであるとして同行為の差止仮処分の申立てをしたと発表しました(2025.11.12ブログ記事「リジェネロン社、アイリーア®特許権に基づき大阪地裁に富士製薬工業アフリベルセプトBSの差止仮処分申立て」参照)。

もし仮に、先発メーカーであるリジェネロン/バイエルが厚労省のサムスンおよび富士薬品工業のバイオ後続品に対する承認判断に不満、サムスンも厚労省の自社品に対するAMD除外の虫食い判断と富士薬品工業品に対するAMD承認に不満、富士薬品工業も厚労省の自社品に対するDME除外の虫食い判断とサムスン品に対するDME承認に不満を抱いているという三者三様の構図だとすれば、これらの混乱のすべては厚労省によるパテントリンケージでの判断が透明性を欠いていることに問題があるといわざるを得ないでしょう。
2025年10月8日、厚労省は、日本のパテントリンケージ制度の根拠となっている平成21年の二課長通知を改正する新たな通知「医療用後発医薬品及びバイオ後続品に関する医薬品医療機器等法上の承認審査及び薬価収載に係る医薬品特許の取扱いについて」(令和7年10月8日付け医政産情企発1008第1号・医薬薬審発1008第5号、医政局医薬産業振興・医療情報企画課長、医薬局医薬品審査管理課長 連名通知)を発出しました。この改正により、バイオ後続品も正式にパテントリンケージ制度の対象として明記され、医薬品特許情報報告票の提出期限も明確化されました(2025.10.11ブログ記事「厚労省、日本版パテントリンケージ制度の根拠となっている平成21年二課長通知を改正、新たな通知を発出」参照)。

さらに、厚労省は2025年11月14日、このパテントリンケージ制度の運用に、医薬品特許の専門家から意見を聴取できる「専門委員制度」を試行的に導入することを示した「医療⽤後発医薬品及びバイオ後続品の承認審査に際する特許抵触の有無の確認における専⾨委員制度導⼊の試⾏について」と題する通知(医薬薬審発1114第1号)を発出しました(2025.11.14ブログ記事「厚労省、パテントリンケージの運用に専⾨委員制度を試行的に導⼊」参照)。

しかし、この専門家意見は裁判所による法的拘束力ある判断に代わるものではなく、行政による判断が司法の専権領域に踏み込むという根本問題を解消することはできません。したがって、制度をより明確かつ透明に運用するには、部分的な改良にとどまらず、パテントリンケージ制度そのものを法律上で明確に位置づけ、根本的に再設計することが必要なのではないでしょうか。
10.職務発明規程適用の「不確実性」
2025年には、職務発明規程の適用に潜む「不確実性」を浮き彫りにする事件がありました。被告・日本新薬の元従業員である原告Aは、在職中に職務上完成させたセレキシパグに関する発明について、平成16年改正前の特許法35条に基づき、特許を受ける権利を会社に承継させたことに対する「相当の対価」として、約5億円の支払いを求めました。
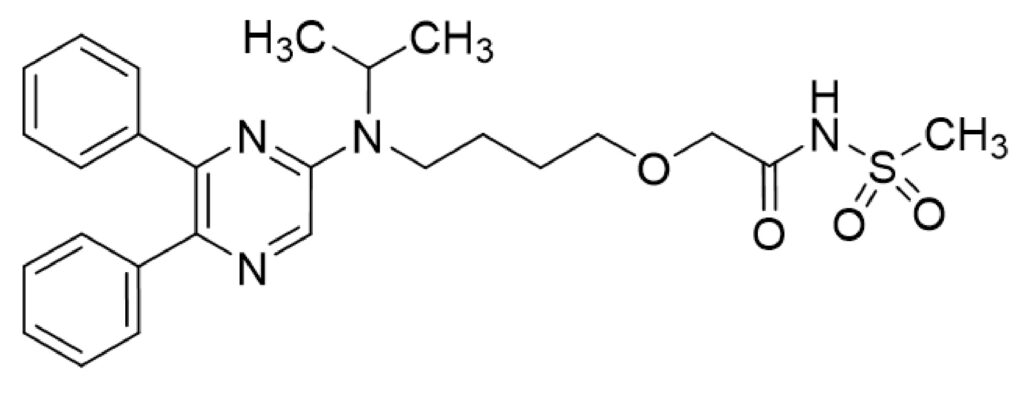 医薬品産業は製品を保護する特許件数が相対的に少なく、1件の特許の経済的価値が極めて大きいことから、対価請求額が高額化しやすいという特徴があります。セレキシパグは、日本新薬の主力品である肺動脈性肺高血圧症(PAH)治療薬「ウプトラビ®」の有効成分であり、数年後に迫るパテントクリフ克服を最重要経営課題とする同社にとって、その基本特許をめぐる訴訟は特に注目されました。
医薬品産業は製品を保護する特許件数が相対的に少なく、1件の特許の経済的価値が極めて大きいことから、対価請求額が高額化しやすいという特徴があります。セレキシパグは、日本新薬の主力品である肺動脈性肺高血圧症(PAH)治療薬「ウプトラビ®」の有効成分であり、数年後に迫るパテントクリフ克服を最重要経営課題とする同社にとって、その基本特許をめぐる訴訟は特に注目されました。
大阪地裁は、相当の対価の算定にあたり、被告が主張する職務発明規程の適用を認めず、平成16年改正前の特許法35条に基づく算定を相当と判断しました。その上で、原告に約9,400万円を支払うよう命じました。本判決は、企業が職務発明規程を有効に機能させるには、従業員から明示的な同意書を得ることが不可欠である一方、改正前法が適用される発明では合意形成が難しく、結局は裁判所の判断に委ねられる場合があることを示しています(2025.08.24ブログ記事「2025.03.28 「A v. 日本新薬」 大阪地裁令和4年(ワ)11405 ― 迫るパテントクリフの陰で勃発したウプトラビ®職務発明の相当対価請求事件」参照)。

平成16年改正前法の適用が残る発明については、当時の同意の有無や契約解釈が紛争に直結するリスクが高く、規程の存在だけでは企業の主張が通らない可能性も十分にあります。特許法35条はその後の改正で一定の整備が進んだものの、実務上は依然として「不確実性」が残存しています。本件のように、相当対価をめぐって発明者と企業が対立し、最終的に裁判所判断に委ねられる構図が繰り返される現実は、制度の限界と企業内合意形成の難しさを改めて浮き彫りにしました。制度が現行法に整備された現在においても、過渡期の発明をめぐる法的リスクが依然として顕在であることを如実に示す事例といえます。
11.二年連続で「実現」
2025年3月1日、『医薬系特許的判例ブログ年報2024』を発行いたしました。本書は、当ブログで注目いただいた2024年の記事を中心に書籍用として再編集したものです(2025.03.02ブログ記事「医薬系特許的判例ブログ年報 2024」参照)。

自己満足の延長ではありますが、出版社を介さず印刷所に直接依頼し製本したため非売品となっております。その一方で、国立国会図書館に納本しており、閲覧可能な書籍として保管いただいております(国立国会図書館書誌ID:033951605)。
昨年に引き続き、2年連続で年報発行を「実現」できましたことは、日頃より当ブログを応援してくださる皆さまのおかげです。心より御礼申し上げます。本書が、医薬品の特許の世界を理解いただく一助となれば幸いです。

宣伝するために無理やり「実」と結びつけてないか?
また、2025年版についても、2026年春の発行を目指して鋭意準備を進めてまいります。今後とも変わらぬご支援を賜れましたら幸いです。
おわりに
本記事では、「実」をテーマに、
1.延長効力の「実質同一」
2.PCSK9抗体事件の「実施例」
3.CRISPR/Cas9と「実験」の成功
4.引用発明の「実施可能性」と「実証性」
5.AI発明と「実務上の課題」
6.大合議判決と「医療行為の円滑な実施」
7.パンデミック協定と「実効的な国際協力」
8.「裁定通常実施権」の運用改善
9.パテントリンケージと「虚偽の事実の告知」
10.職務発明規程適用の「不確実性」」
11.二年連続で「実現」
といった、2025年を賑わせた医薬系“特許的”な出来事について振り返ってきました。
一年を振り返ってみて、読者の皆さまはどのようなことを感じられたでしょうか。皆さまにとって、この一年は「実り」の多い年であったでしょうか。
2025年は干支でいうと「乙巳(きのとみ)」の年にあたります。乙巳は、これまでの努力が「実を結ぶ」成長と結実の年とされます。一年を振り返れば、多くの「実」が確かに積み重なったことが感じられるのではないでしょうか。制度や裁判例の議論は一朝一夕で結論が出るものではありませんが、少しずつ地層を厚くしながら、実務の土台を積み重ねた一年であったといえます。
こうして振り返る一年の歩みを、本記事を通じて楽しんでいただけたなら幸いです。
※過去の一年を表す漢字を覚えていますか。
- 「介」:2024年、医薬系”特許的”な出来事を振り返る。
- 「抗」:2023年、医薬系”特許的”な出来事を振り返る。
- 「誰」:2022年、医薬系”特許的”な出来事を振り返る。
- 「共」:2021年、医薬系”特許的”な出来事を振り返る。
ぜひ、当ブログ(https://www.tokkyoteki.com)とX(旧Twitter)(@tokkyoteki)のフォローも何卒よろしくお願いします。
※最後にお知らせです!
毎年恒例、新春「医薬系特許的判例」クロスワードパズルを、2026年元旦にブログ記事としてアップする予定です。
2026年の縁起を担いで、最速で正解のご連絡をいただいた方には「一番福」🧧の称号が勝手に付与されます。
医薬や特許が専門ではないという方も、最後のヒントで必ず解るようになっていますので、ぜひ、お気軽にチャレンジしてくださいね♪
こたつに入って、みかん🍊でも食べながら、ぜひお楽しみください。

それでは、皆さま、良いお年をお迎えください。
※ご覧いただきありがとうございます。この記事の内容について、読者の皆さまのご意見や気づきもぜひお聞かせください!
以下のようなご感想・質問、大歓迎です!
- 🤔ここ理解しづらいな、という部分はありましたか?
- 🤔このニュース、事件、判決例の実務影響についてご意見ありますか?
- 🤔過去の類似事例や判決例をご存じでしたら教えてください!
- 🤔恥ずかしい質問、つぶやき、大歓迎です
- 「👍」「なるほど」「疑問あり」だけでもOK!
コメント欄は↓ コメントは匿名OK! ぜひ気軽に投稿してください🙇
皆さんの反応が、次回の記事や解説のヒントになります🥰
Robot icons created by Freepik – Flaticon; Robot icons created by Freepik – Flaticon: Robot cat icons created by Freepik – Flaticon






コメント