 *Topics
*Topics 2020年、医薬系”特許的”な出来事を振り返る。
2020年の医薬系"特許的"な出来事を振り返りました。COVID-19に対するイノベーションのレジリエンス、パテントリンケージシステムの不透明感、進歩性の顕著な効果、抗PD-1/PD-L1抗体発明の帰属をめぐる争い、プラルエント®販売停止発表・・・振り返るといろいろあったよね・・・1.COVID-19パンデミック危機に対するイノベーションのレジリエンス今年初めから世界的に蔓延した新型コロナウイルス...
 *Topics
*Topics 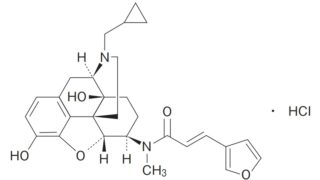 *Case2020
*Case2020  *Case2020
*Case2020  *Topics
*Topics 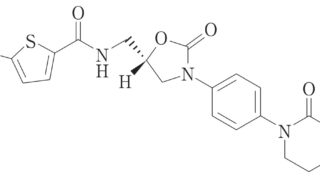 *Pharma/IP news
*Pharma/IP news  *Pharma/IP news
*Pharma/IP news 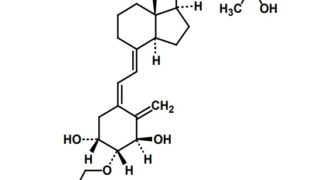 *Pharma/IP news
*Pharma/IP news  *Pharma/IP news
*Pharma/IP news 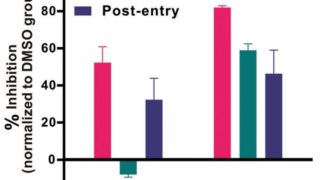 *Pharma/IP news
*Pharma/IP news  *Topics
*Topics 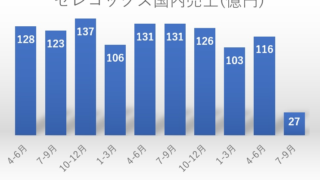 *Case2020
*Case2020 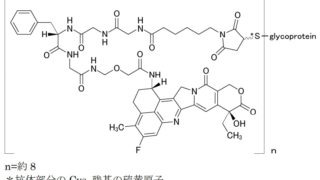 *Pharma/IP news
*Pharma/IP news  *Case2020
*Case2020 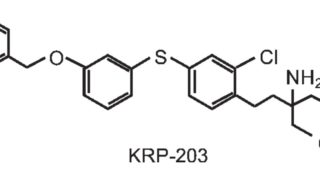 *Pharma/IP news
*Pharma/IP news  *Case2020
*Case2020 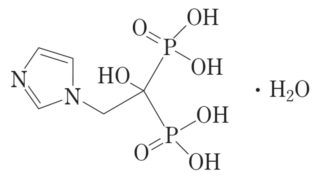 *Pharma/IP news
*Pharma/IP news 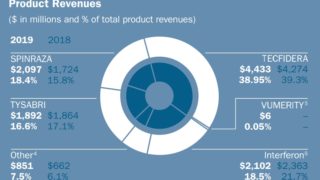 *Pharma/IP news
*Pharma/IP news 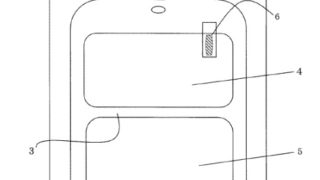 *Case2020
*Case2020 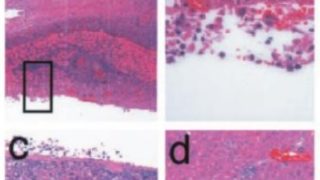 *Case2020
*Case2020  *Case2020
*Case2020 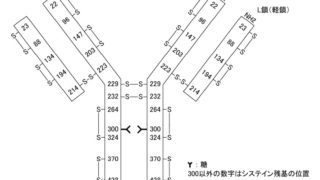 *Pharma/IP news
*Pharma/IP news 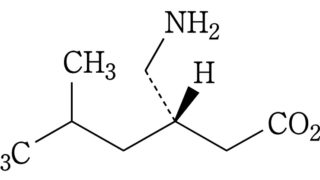 *Case2020
*Case2020 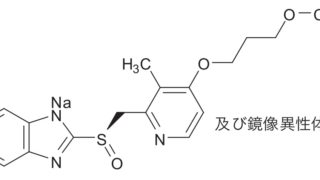 *Pharma/IP news
*Pharma/IP news 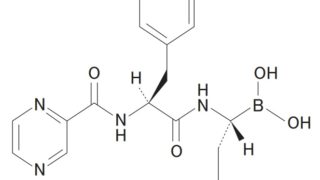 *Case2020
*Case2020  *Pharma/IP news
*Pharma/IP news  *Pharma/IP news
*Pharma/IP news  *Pharma/IP news
*Pharma/IP news  *Pharma/IP news
*Pharma/IP news 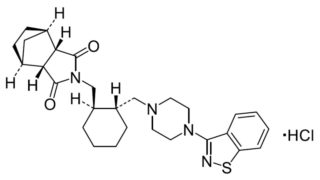 *Pharma/IP news
*Pharma/IP news  *Pharma/IP news
*Pharma/IP news 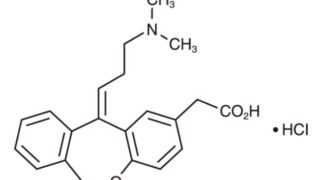 *Case2020
*Case2020 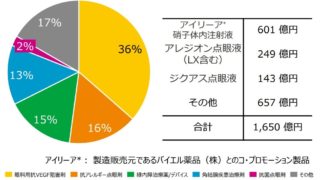 *Pharma/IP news
*Pharma/IP news 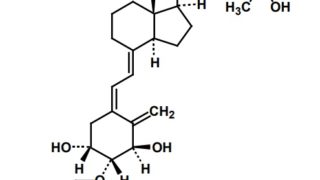 *Pharma/IP news
*Pharma/IP news 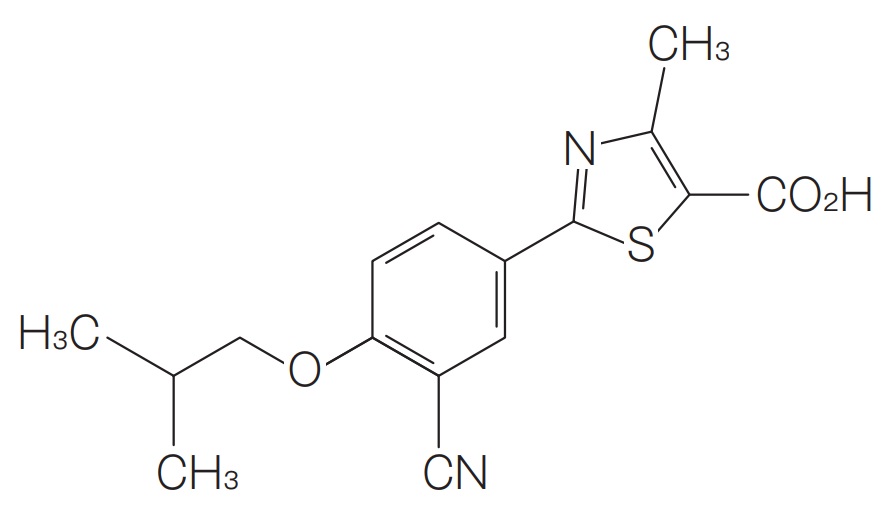 *Pharma/IP news
*Pharma/IP news 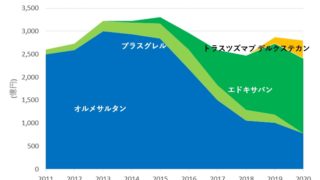 *Pharma/IP news
*Pharma/IP news 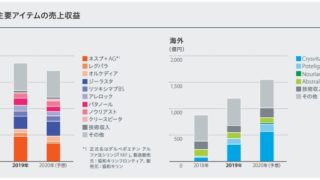 *Pharma/IP news
*Pharma/IP news  *Pharma/IP news
*Pharma/IP news  *Pharma/IP news
*Pharma/IP news 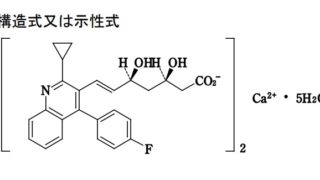 *Pharma/IP news
*Pharma/IP news 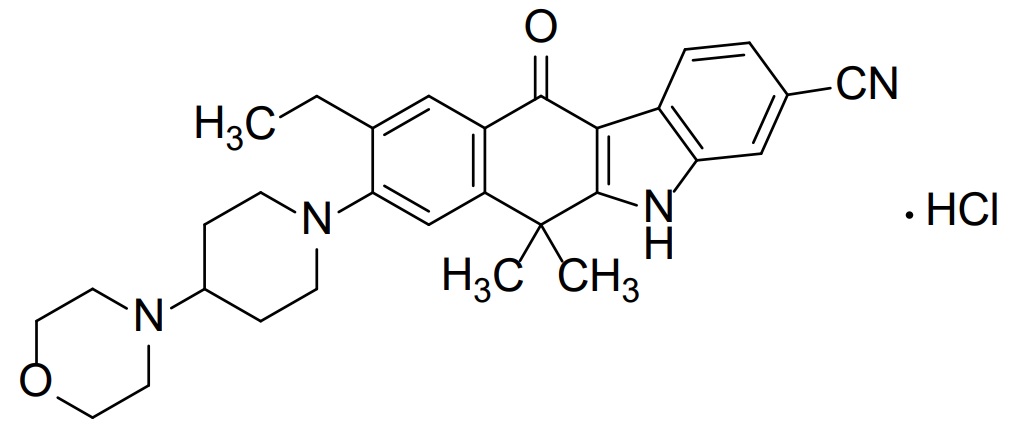 *Pharma/IP news
*Pharma/IP news 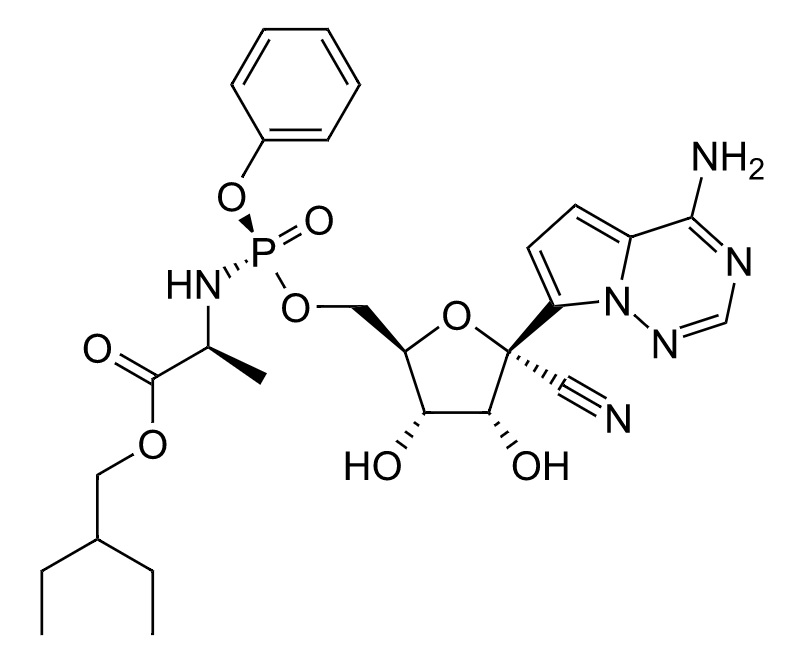 *Pharma/IP news
*Pharma/IP news  *Pharma/IP news
*Pharma/IP news 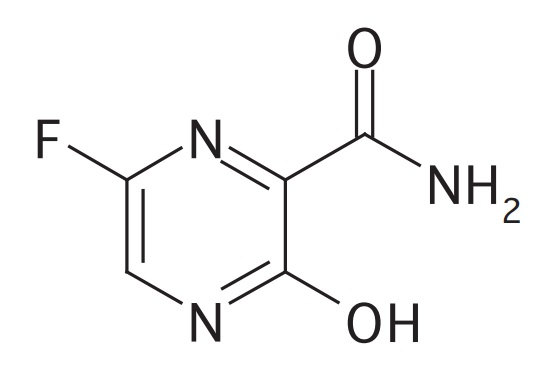 *Pharma/IP news
*Pharma/IP news 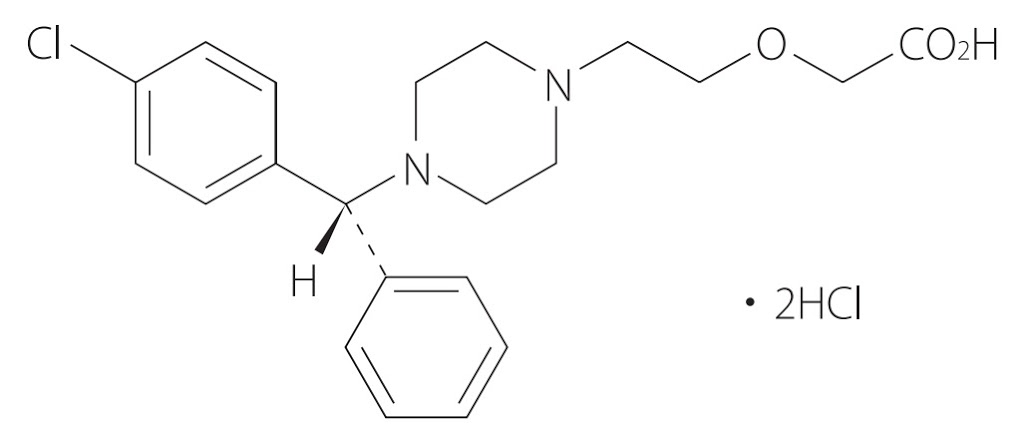 *Pharma/IP news
*Pharma/IP news  *Pharma/IP news
*Pharma/IP news  *Case2020
*Case2020 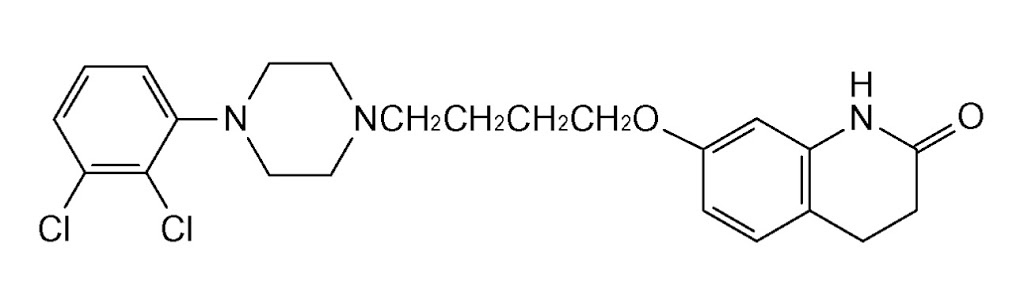 *Pharma/IP news
*Pharma/IP news  *Case2020
*Case2020 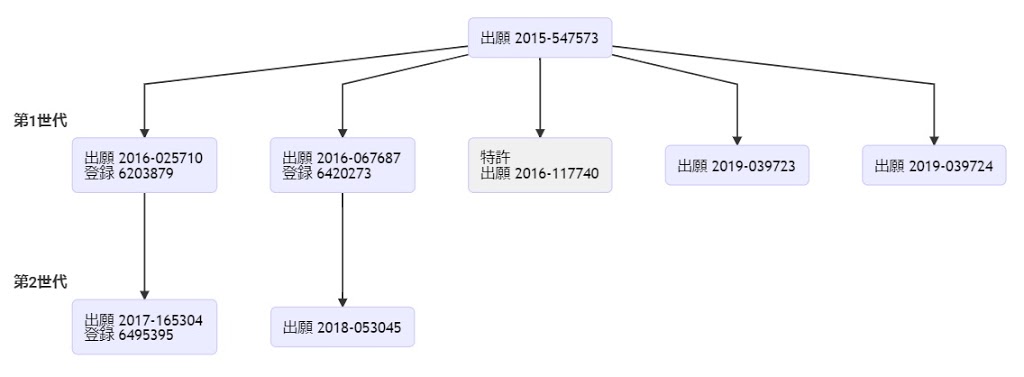 *Case2020
*Case2020  *Case2020
*Case2020